中学2年理科。化学変化の最後の単元に「化学変化と熱」に関する内容が登場します。温度が上昇する発熱反応と、温度が下がる吸熱反応の区別ができるようになりましょう。この単元はポイントをおさえれば簡単に攻略することができるのでさらっとマスターしてしまいましょう。
化学変化と熱
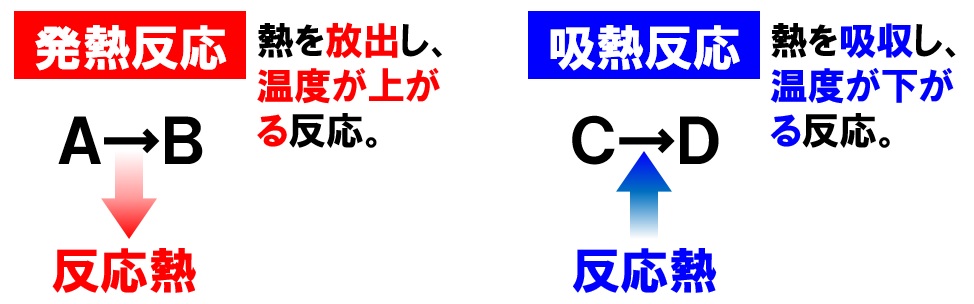
化学変化が起こると、それに伴って熱の移動が発生します。化学変化により物質から熱が出る反応を発熱反応といい、この熱によって温度が上昇します。逆に物質が周囲から熱を吸収する反応を吸熱反応といい、温度が下がります。
- 発熱反応
化学変化により熱が発生し、温度が上がる反応 - 吸熱反応
化学変化により熱を吸収し、温度が下がる反応
式で表すと次のようになります。
- 発熱反応
物質A + 物質B → 物質C + 熱 - 吸熱反応
物質A + 物質B + 熱 → 物質C
反応熱
この化学変化により、放出されたり、吸収されたりする熱のことを反応熱といいます。吸収される熱も放出される熱もどちらも反応熱と呼ばれます。
化学カイロの実験
化学カイロの中身を使って実験をします。回路の中には次の物質が入っています。それぞれ何のために入っているのかまで覚えましょう。
- 鉄粉(鉄)…酸化させ熱を得るため。
- 活性炭(炭)・食塩水…鉄の酸化を程よくするため。
化学カイロは、鉄を酸化させるときに出る熱を利用したものなんですね。

吸熱反応を覚える
どの化学変化が発熱反応か吸熱反応かを覚えなくてはなりません。しかし、化学変化は非常に多いので、全てを覚えることは困難です。
ここでは吸熱反応を覚えるようにしましょう。発熱反応と比べると圧倒的に数が少なく、試験で問われる反応も限られています。以下の3つのキーワードが出てきた場合は吸熱反応だと判断してください。
❷クエン酸(レモン汁)
❸尿素
吸熱反応
塩化アンモニウムと水酸化バリウムを混ぜてしばらくすると、鼻を刺すような臭いのアンモニアが発生します。このとき周囲から熱を吸収し温度が下がります。
塩化アンモニウム+水酸化バリウム→アンモニア+塩化バリウム+水
2NH₄Cl+Ba(OH)₂→2NH₃+BaCl₂+2H₂O
上記の反応式を覚える必要はありませんが、吸熱反応であること、アンモニアが発生することは覚えておきましょう。アンモニアが発生するので、ぬれた紙を試験管の上にかぶせておきます。アンモニアは水に非常に溶けやすいので、ぬれた紙の水分に溶けることになります。
この他に、クエン酸(レモン汁)や尿素などの反応も吸熱反応になりますが、詳しい内容は覚える必要はありません。
発熱反応
この他の化学変化は、すべて発熱反応であると考えて大丈夫でしょう。特によく出題されるのが「化学カイロ」です。カイロの中に入っている鉄粉が、空気中の酸素と反応することで熱が放出されます。この熱で手を温めているんですね。
対策問題 【定期テスト対策問題】化学変化と熱



コメント