原子からどのようにイオンが生じるのかを学習します。ポイントは電子を失うのか受け取るのかです。
イオンとは
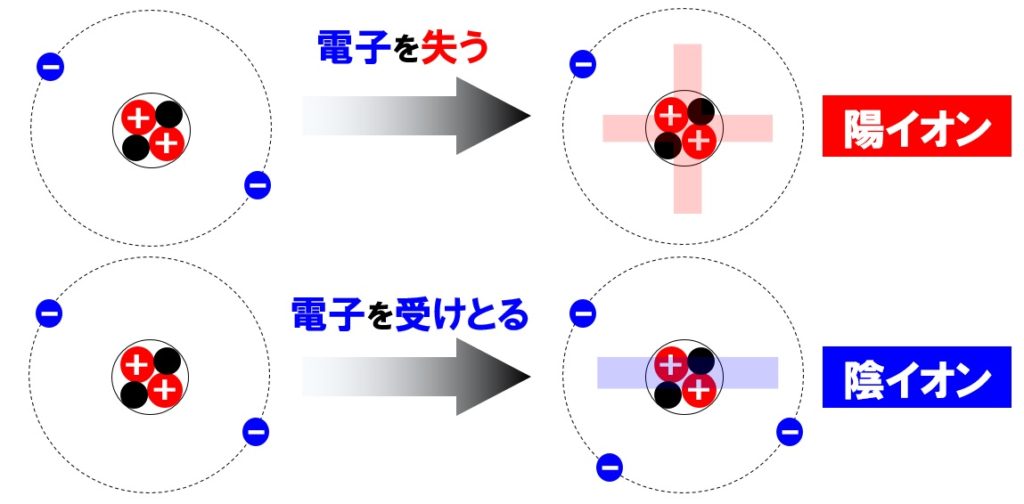
原子は陽子(+)の数と電子(-)の数が等しく電気的に中性でしたが、電子を失ったり、電子を受けとったりすると、+や-の電気を帯びます。電気を帯びると原子とはいわずにイオンとよばれる粒になります。
- イオン…原子が電気を帯びたもの。
陽イオン
イオンの中でも+の電気を帯びたイオンを陽イオンといいます。陽イオンができるには、原子が電子を失うことが必要です。
原子→陽イオン+電子⊖
例としてナトリウム原子が陽イオンのナトリウムイオンになる様子をイオン式や化学式で表してみました。
Na→Na++e⁻(e⁻は電子)
ナトリウム原子→ナトリウムイオン+電子
陽イオンの価数
- 1価の陽イオン
原子が電子を1つ失い、電子よりも陽子が1つ多い状態になったもの。
例)H⁺ Na⁺ - 2価の陽イオン
原子が電子を2つ失い、電子よりも陽子が2つ多い状態になったもの。
例)Ca²⁺ Cu²⁺ - 3価の陽イオン
原子が電子を3つ失い、電子よりも陽子が3つ多い状態になったもの。
例)Al³⁺
陰イオン
イオンの中でも-の電気を帯びたイオンを陰イオンといいます。陰イオンは原子が電子を受けとり、電子が陽子よりも多くなることでできます。
原子+電子⊖→陰イオン
例として塩素原子が陰イオンの塩化物イオンになる様子をイオン式や化学式で表すと次のようになります。
Cl+e⁻→Cl⁻
塩素原子+電子→塩化物イオン
陰イオンの価数
- 1価の陰イオン
原子が電子を1つ受けとり、陽子よりも電子が1つ多い状態になったもの。
例)Cl⁻ OH⁻ - 2価の陰イオン
原子が電子を2つ受けとり、陽子よりも電子が2つ多い状態になったもの。
例)O²⁻ SO₄²⁻ - 3価の陰イオン
原子が電子を3つ受けとり、陽子よりも電子が3つ多い状態になったもの。
例)PO₄³⁻
イオンのでき方ポイント!❶原子が電子を失い、+の電気を帯びると陽イオンになる。
❷原子が電子を受けとり、-の電気を帯びると陰イオンになる。
❷原子が電子を受けとり、-の電気を帯びると陰イオンになる。



コメント