イオンの学習が化学電池まで進むと、あとは酸・アルカリ・中和に関する問題が続きます。酸やアルカリとは何なのか。登場する水素イオンや水酸化物イオンの性質もしっかりと押さえていきましょう。
酸とは
酸とは、水に溶けると酸性を示す物質です。もしあなたがお風呂に入り、お風呂のお湯が酸性になると、あなたは酸ということになります。有名な酸として、塩化水素や二酸化炭素、硫酸などがあります。
酸の電離
酸を水に溶かして水溶液にしたり、加熱して液体にすると電離し、陽イオンと陰イオンが生じます。酸が電離すると必ず水素イオンH⁺という陽イオンが生じます。つまり、水溶液が酸性になる正体は水素イオンH⁺なのです。
- 塩化水素(塩酸)の電離
塩化水素→水素イオン+塩化物イオン
HCl→H⁺+Cl⁻

- 硫酸の電離
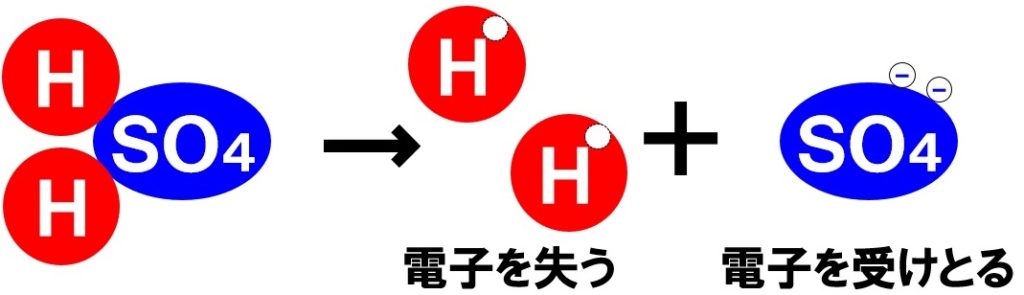
硫酸→水素イオン+硫酸イオン
H₂SO₄→2H⁺+SO₄²⁻
酸性の水溶液の性質
酸を水に溶かし、酸性にした水溶液には次のような特徴があります。
- 青色リトマス紙を赤色に変える。
- 緑色のBTB溶液を黄色に変える。
- pHが7よりも小さい。
- マグネシウムなどの金属と反応し水素が発生する。
- なめると酸っぱい味がする。
水素イオンの移動問題
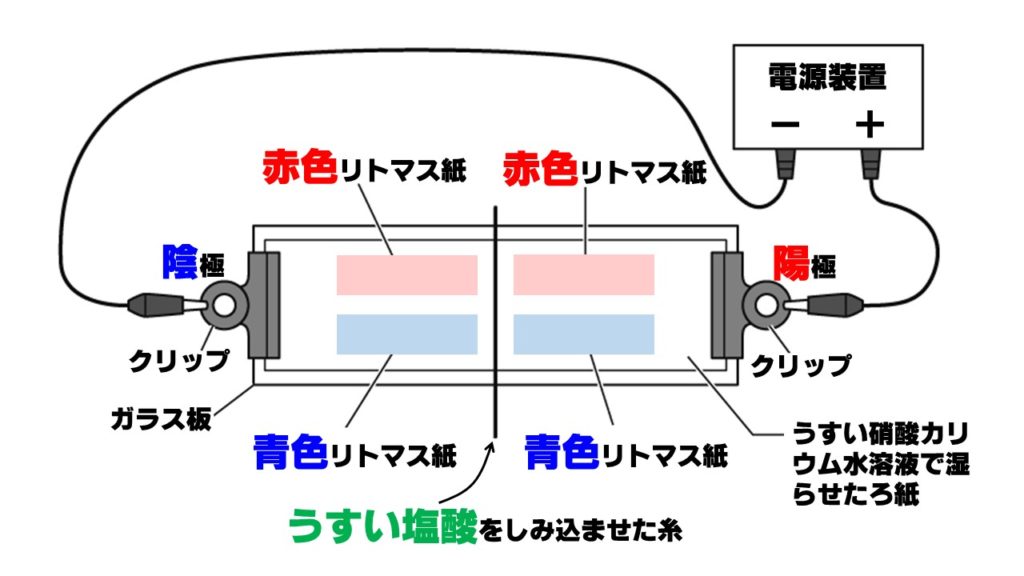
塩酸に含まれるイオンの移動に関する問題です。うすい硝酸カリウム水溶液で湿らせたろ紙の上に、うすい塩酸をしみ込ませた糸を置き、下の図のように、電圧をかけるとどのリトマス紙の色が変化するでしょうか。
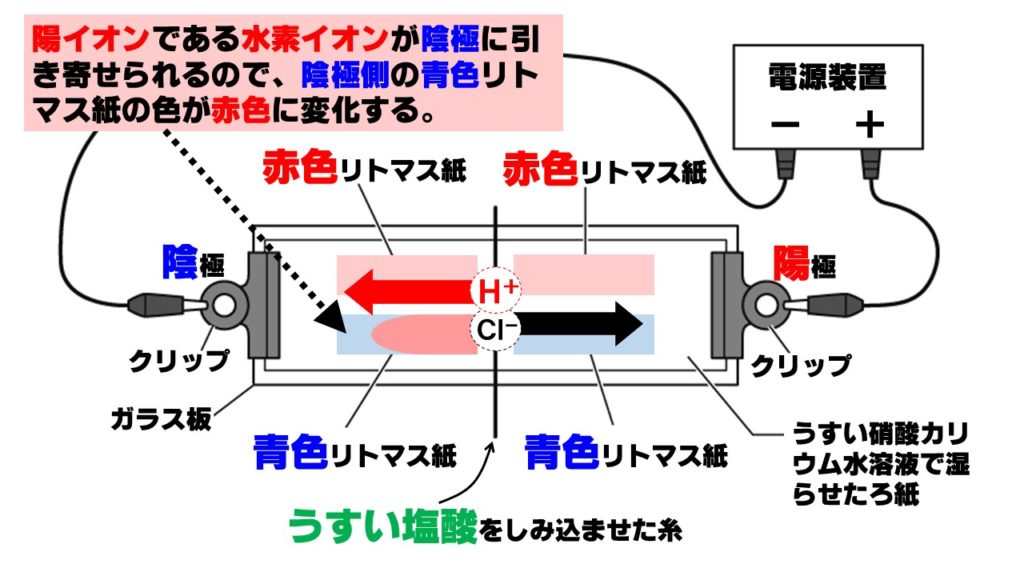
うすい塩酸中のイオンは、陽イオンの水素イオンH⁺と陰イオンの塩化物イオンCl⁻です。電圧をかけると、陽イオンは陰極に、陰イオンは陽極に移動します。
- 陽イオン(水素イオン)H⁺→陰極側へ移動
- 陰イオン(塩化物イオン)Cl⁻→陽極側へ移動
酸性の正体は水素イオンH⁺なので、陰極側の青色リトマス紙が赤色に変化します。
❷リトマス紙を赤色、BTB溶液を黄色にし、pHは7より小さい!
❸水素イオンH⁺は陽イオンなので電圧をかけると陰極に移動!
アルカリとは
アルカリとは、水に溶けるとアルカリ性を示す物質です。もしあなたがお風呂に入り、お風呂のお湯がアルカリ性になると、あなたはアルカリということになります。有名なアルカリとして、水酸化ナトリウムやアンモニア、石灰などがあります。
アルカリの電離
アルカリを溶かすと電離し、陽イオンと陰イオンが生じます。アルカリが電離すると必ず水酸化物イオンOH⁻という陰イオンが生じます。つまり、水溶液がアルカリ性になる正体は水酸化物イオンOH⁻になるのです。
- 水酸化ナトリウムの電離
水酸化ナトリウム→ナトリウムイオン+水酸化物イオン
NaOH→Na⁺+OH⁻

- 水酸化バリウムの電離
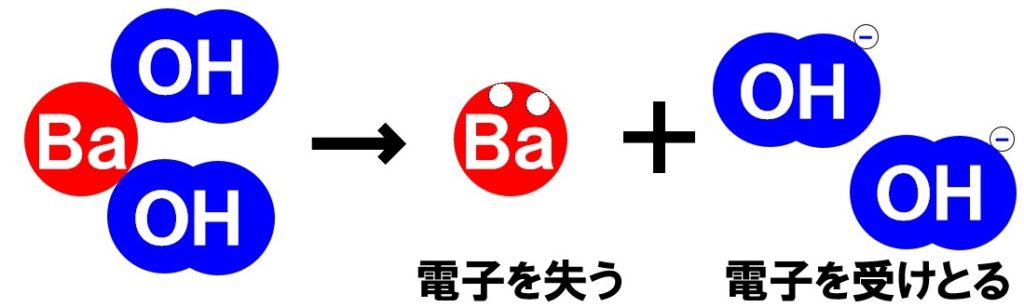
水酸化バリウム→バリウムイオン+水酸化物イオン
Ba(OH)₂→Ba²⁺+2OH⁻
アルカリ性の水溶液の性質
アルカリを水に溶かし、アルカリ性にした水溶液には次のような特徴があります。
- 赤色リトマス紙を青色に変える。
- 緑色のBTB溶液を青色に変える。
- フェノールフタレイン溶液の色を無色透明から赤色に変える。
- pHが7よりも大きい。
- 皮ふをとかす。
水酸化物イオンの移動問題
水酸化ナトリウム水溶液に含まれるイオンの移動に関する問題です。うすい硝酸カリウム水溶液で湿らせたろ紙の上に、水酸化ナトリウム水溶液をしみ込ませた糸を置き、下の図のように、電圧をかけるとどのリトマス紙の色が変化するでしょうか。
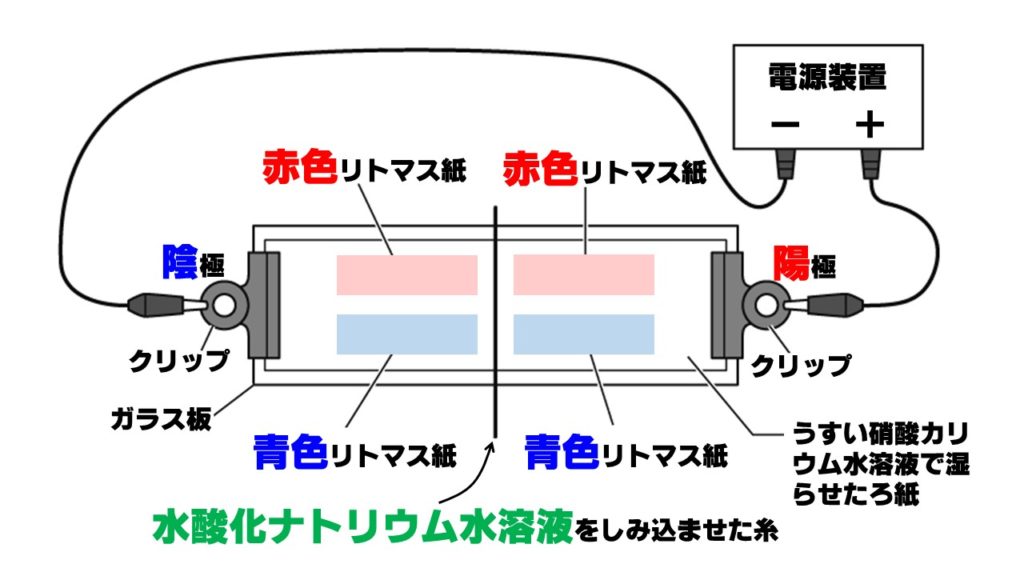
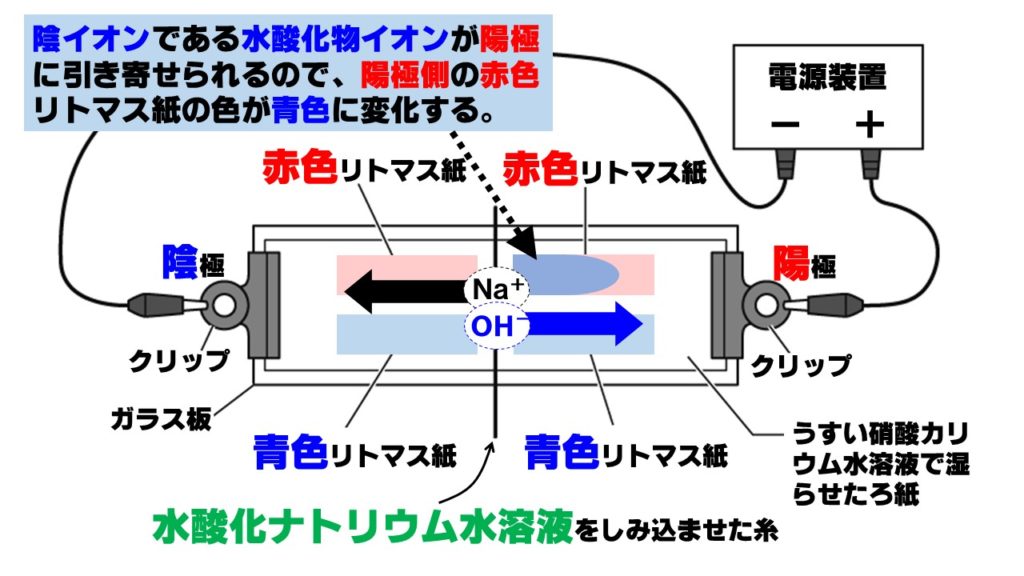
水酸化ナトリウム水溶液中のイオンは、陽イオンのナトリウムイオンNa⁺と陰イオンの水酸化物イオンOH⁻です。電圧をかけると、陽イオンは陰極に、陰イオンは陽極に移動します。
- 陽イオン(ナトリウムイオン)Na⁺→陰極側へ移動
- 陰イオン(水酸化物イオン)OH⁻→陽極側へ移動
アルカリ性の正体は水酸化物イオンOH–なので、陽極側の赤色リトマス紙が青色に変化します。
❷リトマス紙を青色、BTB溶液を青色、フェノールフタレイン溶液を赤色にし、pHは7より大きい!
❸水酸化物イオンOH⁻は陰イオンなので電圧をかけると陽極に移動!
酸性・アルカリ性の水溶液
酸・アルカリの単元でも説明したように、水に溶けると水素イオンH⁺が生じる物質を酸、水酸化物イオンOH⁻が生じる物質をアルカリといいました。
- 塩酸(酸性の水溶液)
HCl→H⁺+Cl⁻ - 水酸化ナトリウム水溶液(アルカリ性の水溶液)
NaOH→Na⁺+OH⁻
今回は、酸性の水溶液で覚えておきたいもの、アルカリ性の水溶液で覚えておきたいものを紹介します。
酸性の水溶液
酸性の水溶液は、名称に「〇〇酸」とつく場合が多いです。また、なめると酸っぱかったり、シュワシュワとする性質があります。
| 酸性の水溶液 | 溶質(溶けているもの) | その他覚えること |
| 塩酸 | 塩化水素(気体) | 刺激臭 |
| 硫酸 | 硫酸(液体) | |
| 炭酸 | 二酸化炭素(気体) | |
| 酢酸(お酢) | 酢酸(液体) | 刺激臭 |
| 雨水 | 二酸化炭素など | |
| レモン汁(クエン酸) | クエン酸 |
酸性を調べる指示薬
水溶液が酸性かどうかを調べるには指示薬を使います。酸性の場合、指示薬の色が次のように変化します。
| 指示薬 | 色の変化 |
| 青色リトマス紙 | 青色→赤色 |
| BTB溶液 | 黄色 |
| pH試験紙 | 赤色 |
アルカリ性の水溶液
アルカリ性の水溶液は、名称に「水酸化〇〇水溶液」という名称がつきます。また、なめると苦かったり、手で触るとぬるぬるする性質があります。
| アルカリ性の水溶液 | 溶質(溶けているもの) | その他覚えること |
| 水酸化ナトリウム水溶液 | 水酸化ナトリウム(固体) | |
| 水酸化バリウム水溶液 | 水酸化バリウム(固体) | |
| アンモニア水 | アンモニア(気体) | 刺激臭 |
| 石灰水 | 石灰(水酸化カルシウム) | 別名は水酸化カルシウム水溶液 |
| セッケン水 | セッケン(固体) |
アルカリ性を調べる指示薬
水溶液がアルカリ性かどうかを調べるには指示薬を使います。アルカリ性の場合、指示薬の色が次のように変化します。
| 指示薬 | 色の変化 |
| 赤色リトマス紙 | 赤色→青色 |
| BTB溶液 | 青色 |
| pH試験紙 | 青色 |
| フェノールフタレイン溶液 | 無色透明→赤色 |
対策問題➊ 【定期テスト対策問題】酸性・アルカリ性の水溶液の判別問題
対策問題➋ 【定期テスト対策問題】リトマス紙の色が変化する酸・アルカリ問題



コメント