【定期テスト対策問題】燃料電池の問題です。
ポイント 【中3理科】燃料電池のポイント
【問題】燃料電池の問題
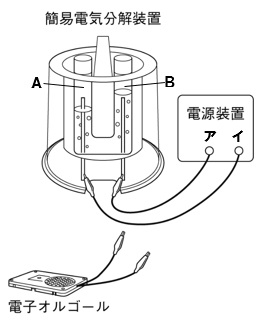 右図のように、簡易電気分解装置に水酸化ナトリウムを溶かした水を入れ電源装置で電圧をかけると、それぞれの電極から気体が発生した。これについて、以下の各問いに答えなさい。
右図のように、簡易電気分解装置に水酸化ナトリウムを溶かした水を入れ電源装置で電圧をかけると、それぞれの電極から気体が発生した。これについて、以下の各問いに答えなさい。
(1)水に水酸化ナトリウムを溶かす理由を簡潔に答えよ。
(2)図の電源装置で、+極になるのはアとイのどちらか。
(3)図の簡易電気分解装置で発生した気体Aと同じ気体を発生させる方法として正しいものを、下のア~エの
中から一つ選び、記号で答えよ。
ア 石灰石にうすい塩酸を加える
イ 二酸化マンガンにオキシドールを加える
ウ 亜鉛にうすい塩酸を加える
エ 塩化アンモニウムと水酸化カルシウムの混合物を加熱する
(4)図の簡易電気分解装置で発生した気体Bを調べる方法とその結果を、簡潔に答えよ。
(5)次に、簡易電気分解装置から電源装置を外し、電子オルゴールをつなげた。電子オルゴールの音が鳴っているとき、簡易電気分解装置の中で起こっている化学変化を、化学反応式で表せ。
(6)水の電気分解で発生した物質で電流を得る装置を何というか。名称を書け。
【解答・解説】燃料電池の解答
(1)小さな電圧で水に電流を流すため。
純粋な水には電流が流れません。水酸化ナトリウムを水に溶かす理由は、小さな電圧で電気分解を進めるためで、電流を流しやすくするという目的があります。
(2)ア
水の電気分解では、陽極に酸素、陰極に水素が発生します。発生する気体の体積比は、酸素:水素=1:2となります。したがって、発生した量が少ないアが陽極で、酸素が発生しています。
(3)ウ
水の電気分解で多く発生する気体は水素です。陰極から発生します。選択肢で水素が発生するのは、金属の亜鉛を塩酸に入れているウになります。アは二酸化炭素、イは酸素、エはアンモニアが発生します。
❶石灰石(炭酸カルシウム)にうすい塩酸→二酸化炭素
❷二酸化マンガンにうすい過酸化水素水(オキシドール)→酸素
❸亜鉛(金属)にうすい塩酸→水素
❹塩化アンモニウムと水酸化カルシウムの混合物を加熱→アンモニア
(4)火を入れると、火が大きくなる
または、「線香がより激しく燃える」
(5)2H₂+O₂→2H₂O
発生した水素と酸素を反応させ、水ができるときに電気エネルギーが放出されます。電流を取り出しているとき、水の電気分解とは逆の反応が起こっています。
燃料電池水素+酸素→水+電気エネルギー
(6)燃料電池
水素と酸素を反応させ、水ができるときに電流を取り出す装置を燃料電池といいます。燃料電池では、電流を取り出した後に水しか残らないので、クリーンなエネルギー源になります。


コメント