イオンと化学変化で、ボルタ電池の次に登場するのがダニエル電池です。ボルタ電池とどこが違うのか考えながら進めてください。
ダニエル電池とは
ダニエル電池とは、イギリス人のジョン・フレデリック・ダニエルが1836年に発明した電池になります。2種類の電解質水溶液が混ざらないようにセロハンや素焼き板で仕切って、亜鉛版(Zn)と銅板(Cu)の2種類の金属を入れた電池です。ボルタ電池と比べると、長い時間電流をとり出すことができるようになっています。
ボルタ電池とダニエル電池の比較
より単純なボルタ電池と、今回学習するダニエル電池を比較してみます。
| ボルタ電池 | ダニエル電池 | |
| +極 | 銅板(Cu) | 銅板(Cu) |
| -極 | 亜鉛版(Zn) | 亜鉛版(Zn) |
| 電解質水溶液 | うすい塩酸や硫酸 | 硫酸亜鉛水溶液と硫酸銅水溶液 |
| 充電 | できない(一次電池) | できない(一次電池) |
+極と-極になる金属板は変わりませんが、使用する電解質水溶液が異なります。また、ダニエル電池では2種類の水溶液を使うので、水溶液が混ざらないように、セロハンや素焼き板で水溶液を仕切ります。
ダニエル電池の詳しい仕組み
ダニエル電池は、水槽やビーカーに硫酸亜鉛水溶液(ZnSO₄)と硫酸銅水溶液(CuSO₄)をセロハン膜で仕切って入れ、硫酸亜鉛水溶液に亜鉛板(Zn)、硫酸銅水溶液に銅板(Cu)を入れ、亜鉛板と銅板を導線でつないだものです。
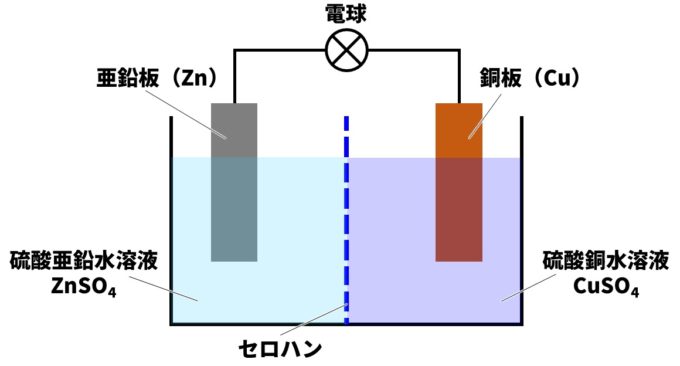
銅よりも亜鉛の方がイオン化傾向が大きいことを利用して、電子の流れを生み出す装置になっています。
ダニエル電池の+極とー極
まずは、電解質水溶液ですが、次のように電離してイオンが存在しています。
- 硫酸亜鉛水溶液
ZnSO₄→Zn²⁺+SO₄²⁻
硫酸亜鉛→亜鉛イオン+硫酸イオン - 硫酸銅水溶液
CuSO₄→Cu²⁺+SO₄²⁻
硫酸銅→銅イオン+硫酸イオン
次に、金属元素のイオン化傾向を考えてみましょう。

亜鉛板(Zn)と銅板(Cu)では、亜鉛の方がイオン化傾向が大きいので、ダニエル電池では亜鉛が溶けてイオンになります。銅はイオン化傾向が小さいので、銅イオン(Cu²⁺)が電子を受け取り銅原子(Cu)になります。
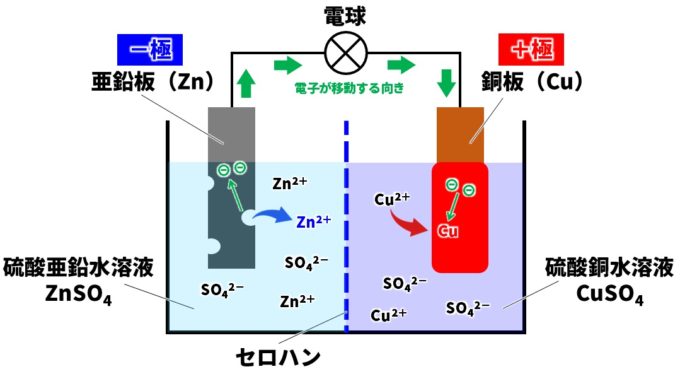
- 亜鉛板での変化
Zn→Zn²⁺+2e⁻
亜鉛→亜鉛イオン+電子 - 銅板での変化
Cu²⁺+2e⁻→Cu
銅イオン+電子→銅
亜鉛板が電子を放出し、銅板に電子が移動しているので、ダニエル電池の極はつぎのようになります。
- 亜鉛板→-極
- 銅板→+極
-極は電子を放出する電極で、+極は電子が流れ込んでくる電極でしたね。
ダニエル電池の電極の変化とセロハンの役割
ダニエル電池を使用していると、亜鉛板と銅板のそれぞれの電極は次のような変化が見られます。
- 亜鉛板→表面がザラザラになり、黒くなる。
- 銅板→表面に赤色の物質である銅がつく。
また、電解質水溶液中のイオンには偏りが生じます。硫酸亜鉛水溶液中に亜鉛板が亜鉛イオンになって溶けだすので、亜鉛イオン(Zn²⁺)が増加しプラスに帯電します。
一方の硫酸銅水溶液中の銅イオン(Cu²⁺)は減少するので、-に帯電します。電子e⁻はマイナスの電気を帯びているので、プラスに帯電した硫酸亜鉛水溶液に引き付けられ、電子の移動が起こりにくくなります。
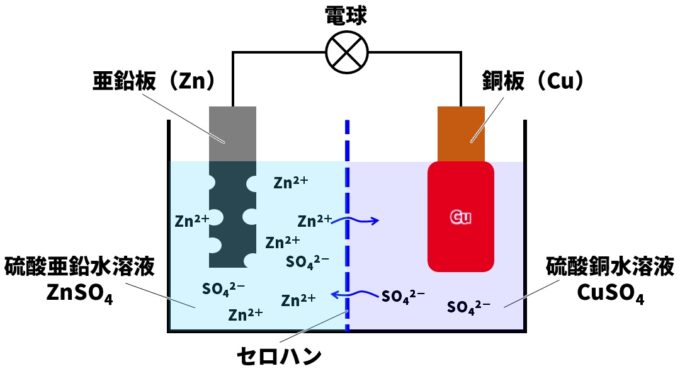
2つの電解質水溶液はセロハンで仕切られていました。セロハンには小さな穴が開いており、水溶液の電気の偏りを解消するように、亜鉛イオンが銅板側へ、硫酸イオンが亜鉛板側に移動します。これで電気のバランスが保たれるわけです。
ダニエル電池の化学変化
ダニエル電池での化学変化を式にまとめると次のようになります。
- -極
Zn→Zn²⁺+2e⁻ - +極
Cu²⁺+2e⁻→Cu
この2つの式をまとめると、
Zn+Cu²⁺→Zn²⁺+Cu
となります。これがダニエル電池で起こっている化学変化になります。
対策問題 【定期テスト対策問題】ダニエル電池の問題

コメント