物質が水に溶けると、陽イオンと陰イオンに分かれる物質があることを学習しました。金属も同じように、水に溶けるとイオンになります。今回は、金属のイオンへのなりやすさについて学習します。
金属のイオンへのなりやすさ
金属のイオンへのなりやすさは、金属の種類によって異なります。硫酸マグネシウム水溶液や硫酸亜鉛水溶液、硫酸銅水溶液などの金属イオンを含む水溶液に、マグネシウム板、亜鉛板、銅板などを入れる実験でイオンへのなりやすさを確認することができます。
しかし、まずは手っ取り早く、金属のイオンへのなりやすさを覚えてしまいましょう。次の5種類の金属のイオンへのなりやすさを、次のように覚えましょう。
イオンになりやすい Mg>Al>Zn>Fe>Cu イオンになりにくい
覚え方は「曲が~る会えん鉄道」です。
鉄道に乗って好きな人に会いに行くんだけど、ぐねぐね曲がるので会えない!というストーリーになっています。
「曲が~る」→「まぐある」→「Mg、Al」
「会えん」→「亜鉛」→「Zn」
「鉄道」→「鉄銅」→「Fe、Cu」
金属のイオン化傾向
ここまで覚える必要はありませんが、高校生になって化学を勉強すると、金属のイオン化傾向を覚えさせられます。金属をイオン化傾向の大きい順に並べると、
Li K Ca Na Mg Al Ze Fe Ni Sn Pb (H₂) Cu Hg Ag Pt Au
このようになります。中学校の定期テスト、高校入試問題では必要ありませんので、興味がある方のみ覚えましょう。
金属がイオンになるときの化学反応式
金属が溶けるとき、必ず電子を失って陽イオンになります。電子をe⁻という記号を使って表すと次のような化学反応式で表します。
●ナトリウム原子がナトリウムイオンになるとき
Na → Na⁺ + e⁻
ナトリウム原子が電子を1つ失って、ナトリウムイオンになります。
●銅原子が銅イオンになるとき
Cu → Cu²⁺ + 2e⁻
銅原子が電子を2つ失って、銅イオンになります。
●亜鉛原子が亜鉛イオンになるとき
Zn → Zn²⁺ + 2e⁻
亜鉛原子が電子を2つ失って、亜鉛イオンになります。
●マグネシウム原子がマグネシウムイオンになるとき
Mg → Mg²⁺ + 2e⁻
マグネシウム原子が電子を2つ失って、マグネシウムイオンになります。
イオンが金属に戻るときの化学反応式
水溶液中の金属イオンが、電子を受けとって金属として出てきます。析出(せきしゅつ)するといいます。電子をe⁻という記号を使って表すと次のような化学反応式で表します。
●銅イオンが銅原子になるとき
Cu²⁺ + 2e⁻ → Cu
銅イオンが電子を2つ受け取って、銅原子になります。
●亜鉛イオンが亜鉛原子になるとき
Zn²⁺ + 2e⁻ → Zn
亜鉛イオンが電子を2つ受け取って、亜鉛原子になります。
●マグネシウムイオンがマグネシウム原子になるとき
Mg²⁺ + 2e⁻ → Mg
マグネシウムイオンが電子を2つ受け取って、マグネシウム原子になります。
金属イオンを含む水溶液に金属板を入れる実験
硫酸マグネシウム水溶液や硫酸亜鉛水溶液、硫酸銅水溶液などの金属イオンを含む水溶液に、マグネシウム板、亜鉛板、銅板などの金属板を入れる実験です。「曲が~る会えん鉄道」を知っておけば簡単に解くことができます。
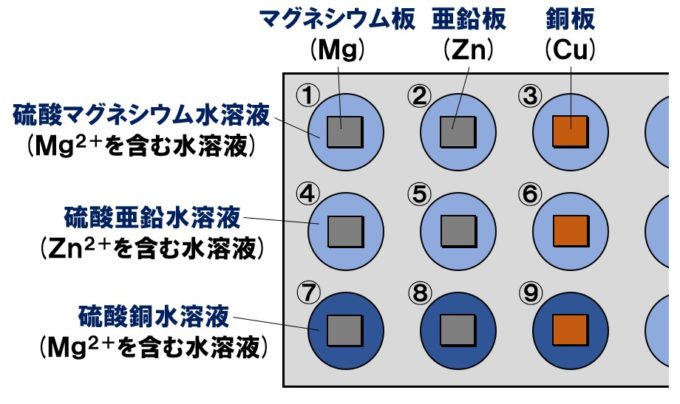
| マグネシウム板 | 亜鉛板 | 銅板 | |
| 硫酸マグネシウム水溶液 (Mg²⁺を含む水溶液) |
変化なし | 変化なし | 変化なし |
| 硫酸亜鉛水溶液 (Zn²⁺を含む水溶液) |
金属板が薄くなり 黒い物質Znが析出 |
変化なし | 変化なし |
| 硫酸銅水溶液 (Cu²⁺を含む水溶液) |
金属板が薄くなり 赤い物質Cuが析出 |
金属板が薄くなり 赤い物質Cuが付着 |
変化なし |
硫酸銅水溶液は青色の水溶液(水溶液中に銅イオンCu²⁺があるので)だが、⑦、⑧では、水溶液の色がだんだんうすくなった。
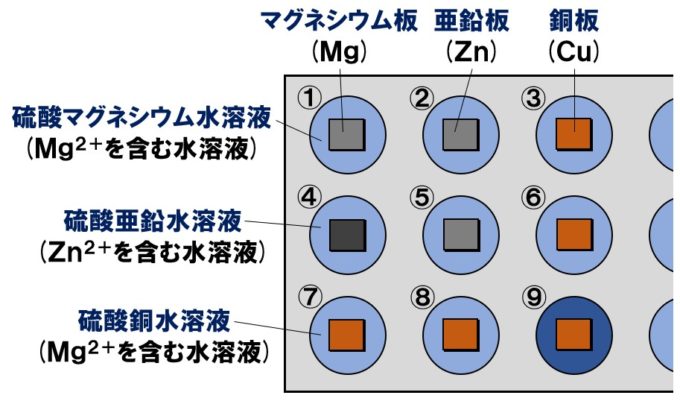
マイクロプレート内①~⑨の説明
①硫酸マグネシウム水溶液(Mg²⁺)とマグネシウム板(Mg)
同じMgどうしなので、変化しません。
②硫酸マグネシウム水溶液(Mg²⁺)と亜鉛板(Zn)
イオン化傾向が大きい順に「Mg、Al、Zn、Fe、Cu」
イオン化傾向がMg>Znなので、Mgのほうがイオンになりたい!
もうすでにMgがイオンなので変化しない。
③硫酸マグネシウム水溶液(Mg²⁺)と銅板(Cu)
イオン化傾向が大きい順に「Mg、Al、Zn、Fe、Cu」
イオン化傾向がMg>Cuなので、Mgのほうがイオンになりたい!
もうすでにMgがイオンなので変化しない。
④硫酸亜鉛水溶液(Zn²⁺)とマグネシウム板(Mg)
イオン化傾向が大きい順に「Mg、Al、Zn、Fe、Cu」
イオン化傾向がMg>Znなので、Mgのほうがイオンになりたい!
Mgが電子を失いMg²⁺になり、Mg→Mg²⁺+2e⁻
Zn²⁺は電子を受け取りZnになる。Zn²⁺+2e⁻→Zn
⑤硫酸亜鉛水溶液(Zn²⁺)と亜鉛板(Zn)
同じZnどうしなので、変化しません。
⑥硫酸亜鉛水溶液(Zn²⁺)と銅板(Cu)
イオン化傾向が大きい順に「Mg、Al、Zn、Fe、Cu」
イオン化傾向がZn>Cuなので、Znのほうがイオンになりたい!
もうすでにZnがイオンZnなので変化しない。
⑦硫酸銅水溶液(Cu²⁺)とマグネシウム板(Mg)
イオン化傾向が大きい順に「Mg、Al、Zn、Fe、Cu」
イオン化傾向がMg>Cuなので、Mgのほうがイオンになりたい!
Mgが電子を失いMg²⁺になり、Mg→Mg²⁺+2e⁻
Cu²⁺は電子を受け取りCuになる。Cu²⁺+2e⁻→Cu
水溶液中のCu²⁺が減少するので青色が薄くなる。
⑧硫酸銅水溶液(Cu²⁺)と亜鉛板(Zn)
イオン化傾向が大きい順に「Mg、Al、Zn、Fe、Cu」
イオン化傾向がZn>Cuなので、Znのほうがイオンになりたい!
Znが電子を失いZn²⁺になり、Zn→Zn²⁺+2e⁻
Cu²⁺は電子を受け取りCuになる。Cu²⁺+2e⁻→Cu
水溶液中のCu²⁺が減少するので青色が薄くなる。
⑨硫酸銅水溶液(Cu²⁺)と銅板(Cu)
同じCuどうしなので、変化しません。
金属のイオンへのなりやすさ実験のまとめ
一見複雑そうな実験ですが、イオン化傾向「曲が~る会えん鉄道」を使って、1つ1つどちらがイオン化傾向が大きいか確認すれば、必ず解ける問題です。
最後に実験問題の解法手順を確認しておきますね。
- 水溶液中の金属イオンと金属板を確認
- 「曲が~る会えん鉄道」でどちらがイオンになりたいのか調べる
- イオンになりたい金属がすでにイオンになっているのなら変化しない
- イオンになりたい金属が金属板の場合、金属板が溶けてイオンになり、水溶液中の金属イオンが金属になって析出する
- 銅イオンCu²⁺が銅原子Cuに変化した場合は、水溶液の青色がうすくなる
では、問題演習も頑張ってください。
問題演習 【定期テスト対策問題】イオン化傾向の問題

コメント