次は電池の中でもクリーンな電池である燃料電池について学習します。
燃料電池とは
燃料電池とは、水素と酸素が反応し水ができる化学変化を利用した電池で、化学エネルギーを電気エネルギーに変換する装置です。しくみは水の電気分解の逆の反応を起こし発電していることになります。
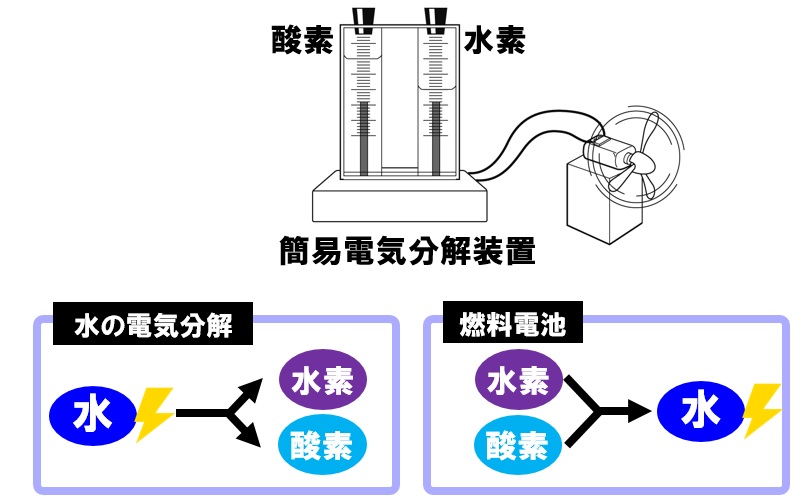
燃料電池の利点は、電気エネルギーをとり出した後に水しか発生しないということがあげられます。実際にスペースシャトルなどでも利用されており、発生した水は飲み水などにも利用されています。非常にクリーンな発電方法で、次世代のエネルギー資源として期待されています。
燃料電池の化学反応式
燃料電池は、水素H₂と酸素O₂が反応し、水ができるときに電気エネルギーを得る装置です。したがって、化学反応式は水素の燃焼と同じ反応式になります。
- 水素+酸素→水+電気エネルギー
- 2H₂+O₂→2H₂O
化学反応式の係数は、反応する気体の体積比にもなっているので、水素と酸素は体積比2:1で反応します。
水の電気分解の逆
燃料電池とあわせて出題されるのは、水の電気分解です。中学2年の化学変化で学習しました。
小さな電圧で電気分解ができるように、水酸化ナトリウムを溶かした水に電極を差し込み電流を流すと、陽極から酸素、陰極から水素が発生します。
- 水+電気エネルギー→水素+酸素
- 2H₂O→2H₂+O₂
出題の内容としては、水を電気分解し、発生した水素と酸素を使って燃料電池の装置をつくるという流れが多いようです。化学反応式の右辺と左辺が逆になりますので、燃料電池と電気分解のどちらの化学反応式をかけといっているのかしっかりと確認してください。
燃料電池を少し詳しく説明
燃料電池では、どのように電気がつくりだされるのか少しだけ詳しくみてみましょう。どのよう水素と酸素が使われ、電子がどのように移動するのかを確認します。発展内容なので、飛ばしても構いません。
- 水素が-極に触れ電子を離し、水素イオンに変化する
H₂ → 2H⁺ + 2e⁻ - -極で取り出された電子が、+極へ移動します。このとき電流は+極から-極に流れます。
- -極で電子を失った水素イオンは、電解質が溶けた水溶液の中に入り+極で電子を受けとり酸素と化合し水になります。
2H⁺ + 2e⁻ + 1/2O₂ → H₂O
上記のイオン反応式を合体させると、燃料電池の化学反応式ができます。
- 2H₂+O₂→2H₂O
このように、燃料電池は水素と酸素が反応し、水ができる過程で電気を発生させる装置になります。
対策問題 【定期テスト対策問題】燃料電池の問題


コメント