【定期テスト対策問題】硫酸と水酸化バリウム水溶液の中和の問題・解説です。
【問題】硫酸と水酸化バリウム水溶液の中和の問題
下の図1のように、ビーカー内のうすい硫酸20cm³に、こまごめピペットを使ってうすい水酸化バリウム水溶液を入れる実験を行った。図2は、加えたうすい水酸化バリウム水溶液の体積と、うすい硫酸とうすい水酸化バリウム水溶液の中和でできた白い物質の質量の変化を表したグラフである。これについて、次の各問いに答えよ。
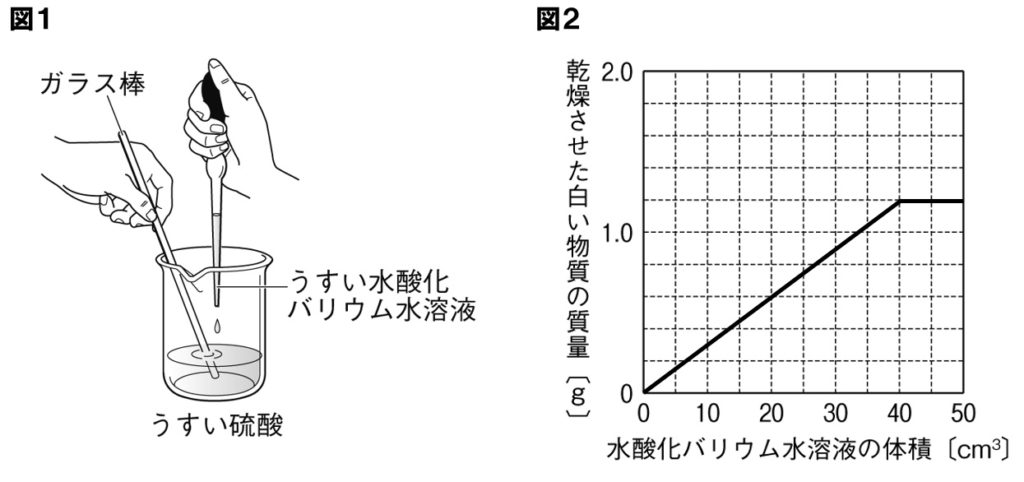
(1)うすい硫酸と、うすい水酸化バリウム水溶液を混ぜると、白い沈殿が生じる。この沈殿は何という物質か。物質の名称を答えよ。
(2)うすい硫酸と、うすい水酸化バリウム水溶液の中和を表す化学反応式を書け。
(3)実験に使ったうすい硫酸20cm³と、うすい水酸化バリウム水溶液50cm³を混ぜたとき、生じる白い物質の質量は何gか。
(4)実験で、うすい塩酸20cm³と、水酸化バリウム水溶液40cm³を混ぜると、水溶液に電流が流れなくなった。この理由を簡潔に答えよ。
(5)実験に使ったうすい硫酸40cm³を完全に中和するには、水酸化バリウム水溶液は何cm³必要か。
【解答・解説】硫酸と水酸化バリウム水溶液の中和の問題
(1)硫酸バリウム
硫酸と水酸化バリウム水溶液の中和でできる塩は、硫酸バリウムになります。硫酸バリウムは水に溶けにくい塩なので、白い沈殿になってビーカーのそこの方にたまります。
硫酸バリウムは水に溶けにくい塩なので、白い沈殿になる!
(2)H₂SO₄+Ba(OH)₂→BaSO₄+2H₂O
硫酸の化学式H₂SO₄は、水酸化バリウムBa(OH)₂の化学式は、塩の硫酸バリウムBaSO₄の化学式になります。中和では、酸のH⁺とアルカリのOH⁻が反応し、水H₂Oができます。
(3)1.2g
グラフより、うすい硫酸20cm³と水酸化バリウム水溶液40cm³が過不足なく反応することがわかります。うすい硫酸は20cm³しかないので、水酸化バリウム水溶液を50cm³混ぜても、できる硫酸バリウムは1.2gで変わりません。
(4)水溶液中にイオンが無くなったから。
硫酸と水酸化バリウム水溶液の中和でできる塩、硫酸バリウムは水に溶けにくい塩で沈殿します。水に溶けないのでイオンとして水溶液中に存在しないので、完全に中和しているときにイオンがまったくない状態になります。したがって、電流は流れません。
水溶液中にNa⁺とCl⁻が存在するから。
・硫酸と水酸化バリウムの完全中和→電流は流れない!
水溶液中にイオンが全くないから。Ba²⁺とSO₄²⁻が結び付いてBaSO₄として沈殿する。
(5)80cm³
グラフから、うすい硫酸20cm³と、水酸化バリウム水溶液40cm³が過不足なく反応していることがわかります。うすい硫酸の量が2倍の40cm³になったので、必要な水酸化バリウム水溶液も2倍の80cm³必要になります。



コメント