【定期テスト対策問題】銅の酸化の計算問題です。
【対策問題】銅の酸化の計算パターン
[問題]下の図のように、銅粉をステンレス皿の上にのせ、うすく広げるようにかき混ぜながら加熱する実験を行った。グラフはこのときの加熱回数と、ステンレス皿の銅粉の質量の変化を示したものである。次の各問いに答えよ。
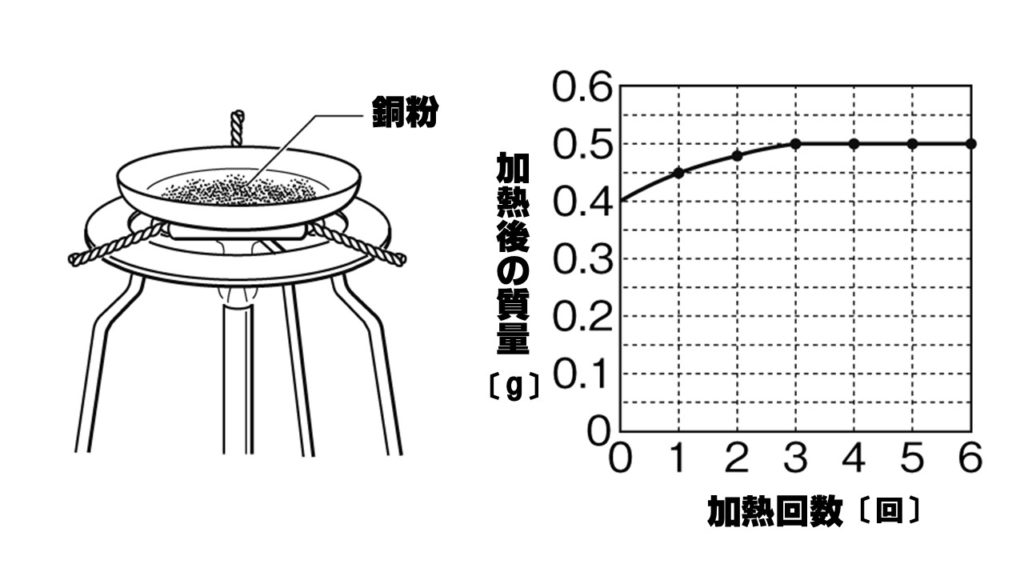
(1)銅粉を加熱するとき、うすく広げるようにかき混ぜながら加熱する理由を答えよ。
(2)銅粉を加熱すると、銅粉の色は何色から何色に変化するか。
(3)グラフから銅粉を何回加熱したとき、銅粉がすべて反応したか。
(4)このとき起こった化学変化を、化学反応式で書け。
(5)この実験から、0.4gの銅粉を完全に反応させると、何gの酸化銅ができるとわかるか。
(6)この実験から、0.4gの銅粉を完全に反応させると、何gの酸素が化合するとわかるか。
(7)銅と酸素は、質量比で何対何で反応するとわかるか。最も簡単な整数比で書け。
(8)1.6gの銅を完全に反応させると、何gの酸素が化合するか。
(9)2.0gの銅を完全に反応させると、何gの酸化銅ができるか。
(10)酸化銅を4.0g得るには、何gの銅粉を加熱すればよいか。
(11)この実験で、加熱回数が1回のとき、未反応の銅の質量は何gか。
(12)銅粉4.0gを加熱するところを、誤って銅粉の一部をこぼしてしまったため、加熱後の酸化銅の質量は加熱を繰り返しても4.5gにしかならなかった。こぼした銅粉の質量を求めなさい。
【解答・解説】銅の酸化の計算パターン
(1)空気中の酸素と完全に反応させるため。
銅粉と酸素が完全に反応するように、うすく広げながらかき混ぜて加熱します。
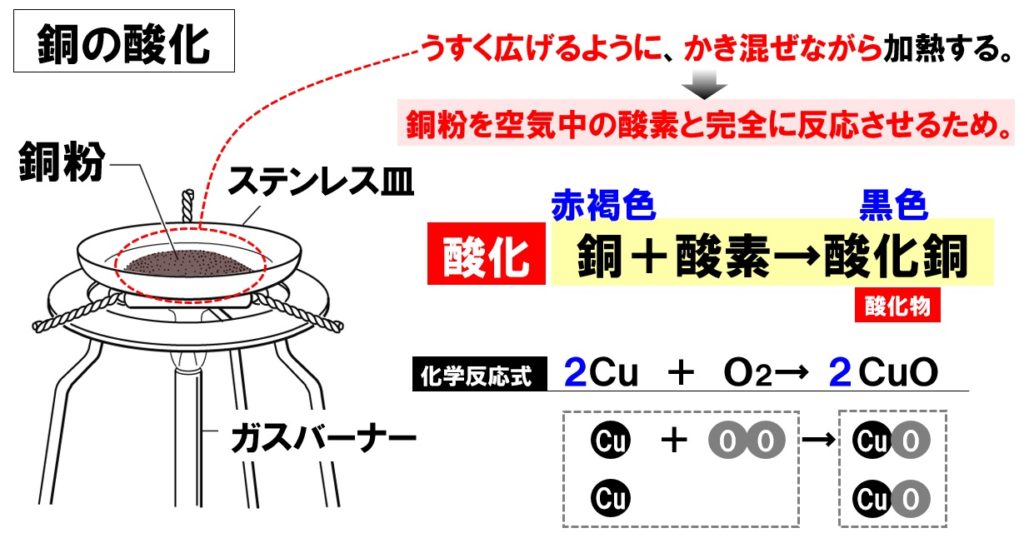
(2)赤褐色(赤色)から黒色
銅の色は赤褐色(赤色)で、酸化銅の色は黒色です。
(3)3回
加熱回数が3回のとき、加熱後の質量が増加していないことからわかります。
(4)2Cu+O₂→2CuO
銅を空気中で加熱すると、銅が酸化され酸化銅ができます。
(5)0.5g
グラフから0.4gの銅を加熱すると、0.5gの酸化銅ができるとわかります。
(6)0.1g
0.4gの銅粉が0.5gになったことから、0.5-0.4=0.1gの酸素が化合したとわかります。
(7)4:1
実験からわかる銅と酸素の質量比は、0.4:0.1=4:1となります。
❷マグネシウム:酸素:酸化マグネシウム=3:2:5
❸鉄:硫黄:硫化鉄=7:4:11
(8)0.4g
銅と酸素の質量比は4:1なので、4:1=1.6:x これを解くとx=0.4となります。
(9)2.5g
銅と酸化銅の質量比は4:5なので、4:5=2.0:x これを解くとx=2.5となります。
(10)3.2g
銅と酸化銅の質量比は4:5なので、4:5=x:4 これを解くとx=3.2gとなります。
(11)0.2g
1回加熱後のステンレス皿の上の物質の質量は0.45gなので、化合した酸素は0.45ー0.4=0.05g。銅と酸素は4:1で反応するので、4:1=x:0.05 これを解くとx=0.2 となり反応した銅が0.2gだとわかります。なので、未反応の銅は0.4ー0.2=0.2gであるとわかります。
0.40g-0.45g=0.05g
❷化合した酸素の質量から反応した銅の質量を求める。
4:1=x:0.05 x=0.20g
❸銅全体の質量から反応した銅の質量を引いて未反応の銅の質量を求める。
0.40g-0.20g=0.20g
(12)0.4g
加熱後の物質の質量は酸化銅の質量なので、反応した銅の質量は、4:5=x:4.5これを解くとx=3.6。加熱した銅の質量が3.6gだったことがわかります。なので、こぼした銅の質量は、4.0ー3.6=0.4gであるとわかります。



コメント