中学2年理科。化学変化について学習していきます。今回のテーマは還元です。酸化銅を銅に戻す化学変化のポイントと問題をまとめています。問題演習では、酸化銅の還元に関するグラフの読み取り問題と計算問題を行います。
還元とは
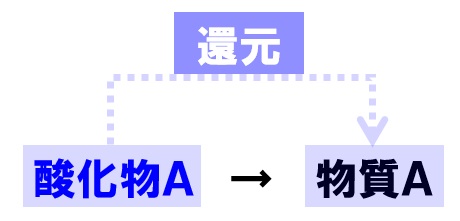
還元とは、簡単にいうと酸化と正反対の反応になります。還元とは、酸化物から酸素をとり去る化学変化です。物質の酸素との反応のしやすさによって、酸化物から酸素をとり去ることができるのです。
還元と酸化は同時に起こる
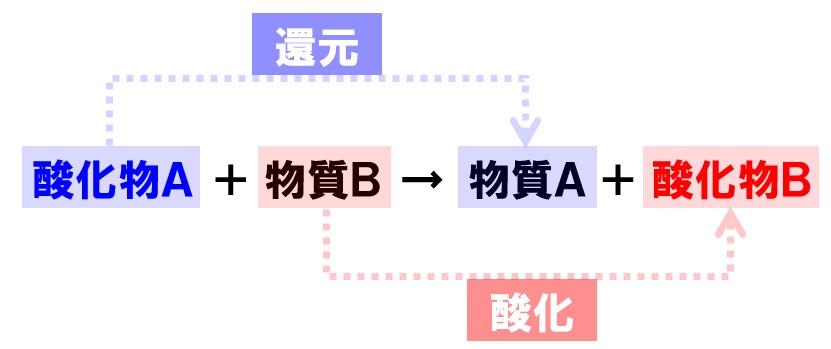
また、このときに酸素をとり去った物質は、酸化されることも覚えておきましょう。つまり、還元が起こると、同時に酸化という化学変化も起こることになります。
酸化銅の炭素による還元
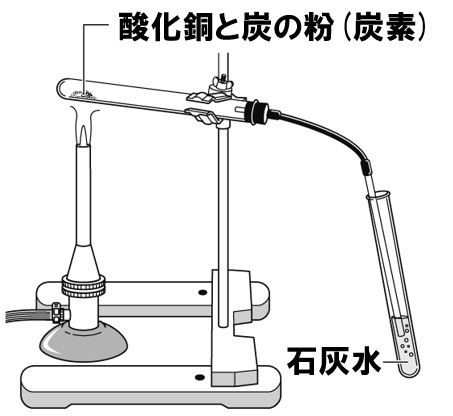
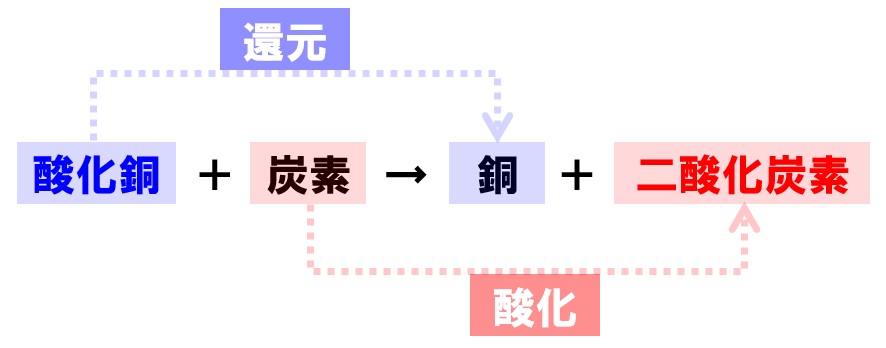
銅を空気中で加熱すると、空気中の酸素が化合して黒色の酸化銅になります。この酸化銅をただ加熱しても何の変化も起こりませんが、炭の粉(炭素)を混ぜて加熱すると、酸化銅から酸素が外れて銅に還元され、炭素は逆に酸素が化合して二酸化炭素になります。
酸化銅の色の変化
黒色の酸化銅ですが、炭素によって完全に還元が完了すると、赤褐色の銅になります。色の変化を聞いてきますので、しっかりと覚えておきましょう。また酸化銅は金属ではありませんが、銅には金属の性質が現れます。
- みがくと金属特有の光沢がでる。
- たたいてのばしたり、曲げたり加工がしやすい。
- 熱や電気をよく通す。
発生する気体は二酸化炭素です。石灰水に通すと白くにごることは大丈夫でしょう。
還元されたもの、還元されてできたもの
ここで、みんながよく間違う問題が出題されます。それは、「還元されたもの」「還元されてできたもの」と「酸化されたもの」「酸化されてできたもの」です。
- 還元されたもの→酸化銅
- 還元されてできたもの→銅
- 酸化されたもの→炭素
- 酸化されてできたもの→二酸化炭素
酸素と化合しやすい原子
また、この実験で、酸素と化合しやすい原子が何であるかもわかります。加熱前は銅Cuと酸素Oが結合していましたが、加熱後は炭素Cと酸素Oが結合しています。
このことから、酸素Oは、銅Cuよりも炭素Cと結合しやすいことがわかります。
酸化銅の炭素による還元の化学反応式
酸化銅の還元の化学反応式は、入試でも超頻出の化学反応式になります。絶対にかけるようになっておきましょう。
酸化銅+炭素→銅+二酸化炭素
2CuO+C→2Cu+CO₂
酸化銅CuOと銅Cuの前に、係数2をつけることを忘れずに。
酸化銅の水素による還元
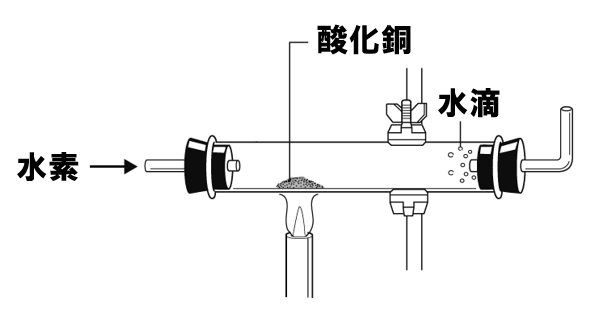
酸化銅は、炭素Cだけでなく水素H₂によっても還元できます。これは、酸素Oが銅Cuよりも水素Hと結合しやすいからです。水素は酸化されて水になります。
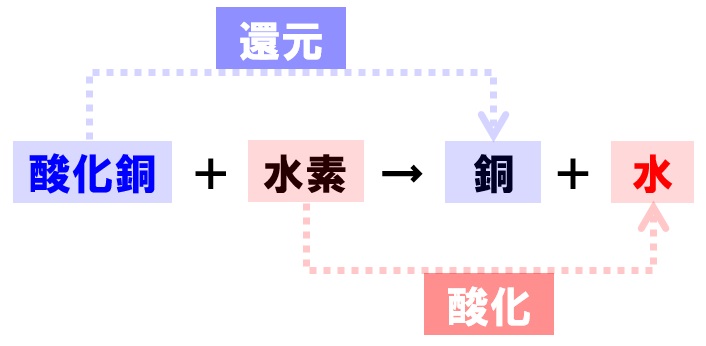
酸化銅の水素による還元の化学反応式
酸化銅を水素で還元したときは、そのままで原子の数が一致しているので、係数をつける必要はありません。
酸化銅+水素→銅+水
CuO+H₂→Cu+H₂O
酸化銅は有機物でも還元できる
酸化銅は、炭素Cと水素Hで還元できることがわかりました。ということは、炭素Cと水素Hを含む物質である有機物で酸化銅は還元できることになります。有機物は炭素Cと水素Hを含む物質で、有機物を燃焼させると、二酸化炭素CO₂と水H₂Oが発生しましたね。
酸化銅+有機物(C、H)→銅+二酸化炭素(CO₂)+水(H₂O)
人類は、地球上にある酸化銅を有機物で還元することで、銅という金属を使えるようになったのですね。
二酸化炭素の還元
二酸化炭素CO₂も還元することができます。二酸化炭素CO₂は炭素Cに酸素Oが化合した物質です。これに、炭素Cよりも酸素Oと仲がよいマグネシウムMgを混ぜて加熱することで、二酸化炭素CO₂から酸素Oを取り去ることができます。
二酸化炭素を還元すると、炭素が残りますので試験管の内側に黒いすすが付きます。
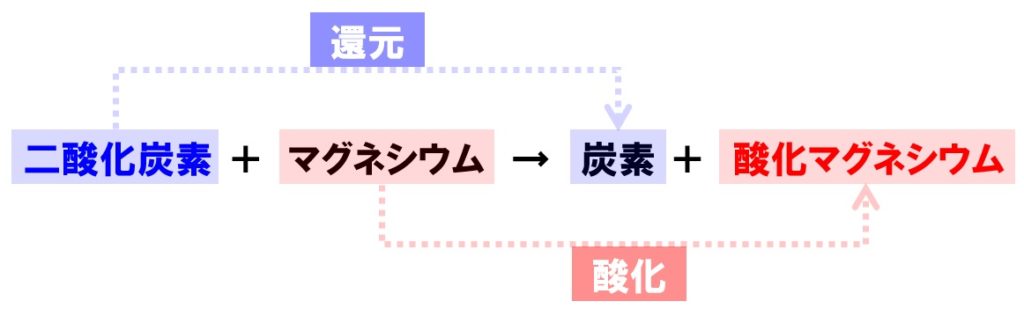
二酸化炭素の還元の化学反応式
化学変化の前後で、酸素Oの数が一致しないので、酸素原子の数を合わせるように係数をつけてください。
二酸化炭素+マグネシウム→炭素+酸化マグネシウム
CO₂+2Mg→C+2MgO
| ▼還元の対策問題を解こう! |
|---|
| 【対策問題】還元の実験問題 |
| 【対策問題】還元の計算問題 |


コメント