中学2年理科の化学変化です。中盤で学習するのが、鉄と硫黄の化合に関する問題です。色の変化やできる物質の性質。化学反応式はもちろん、質量の計算問題まで解けるように練習しましょう。
鉄と硫黄の化合
鉄粉と硫黄の粉末を混ぜて、ガスバーナーで加熱すると、黒色の硫化鉄(りゅうかてつ)ができます。このように2種類以上の物質が結びつき、別の物質になる化学変化を化合といいます。
その中でも、特に硫黄(いおう)が化合する化学変化を硫化といいます。
- 鉄 + 硫黄 → 硫化鉄
Fe + S → FeS
化学反応式も非常にシンプルで分かりやすいので、絶対に書けるようになっておきましょう。
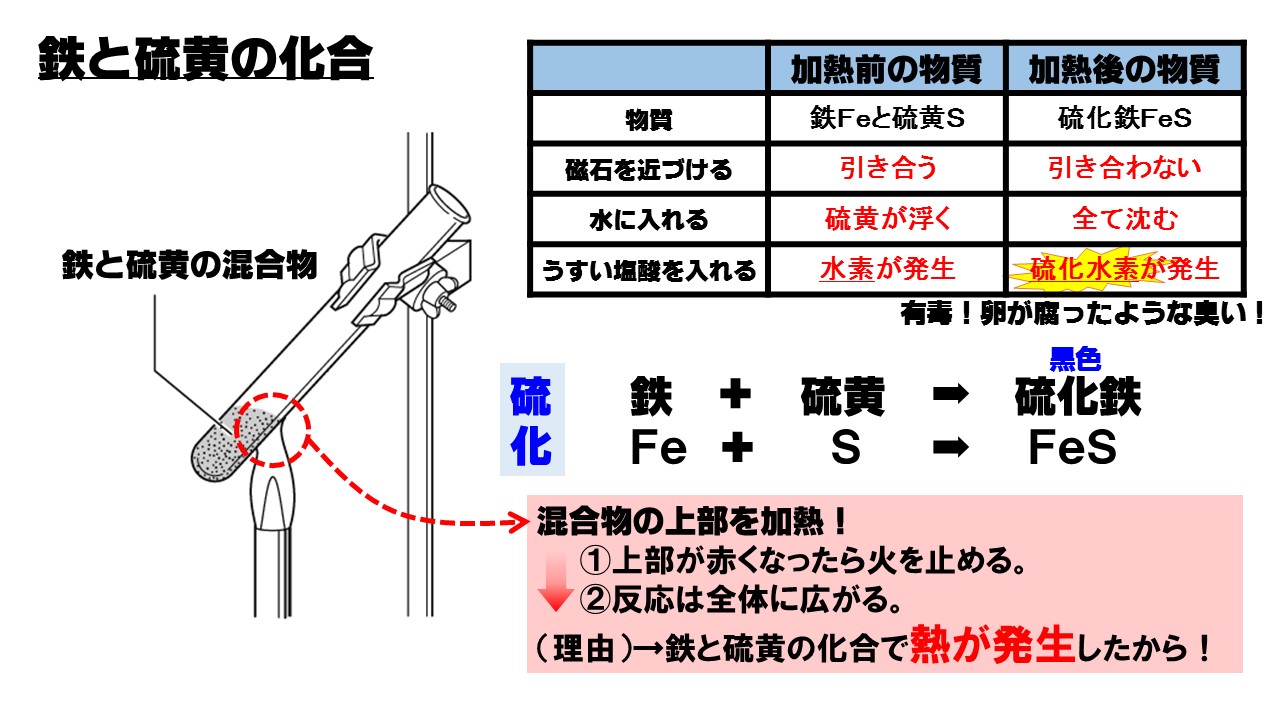
鉄と硫黄の混合物と硫化鉄の違い
鉄と硫黄の化合に関する問題では、反応前の物質と、反応後の物質の違いが問われます。
加熱前の混合物には鉄が入っていますので、磁石に引きつけられます。また、うすい塩酸を入れると水素が発生します。
加熱後は硫化鉄という物質ができていますので、もう鉄ではありません。磁石を近づけても引きつけられませんし、うすい塩酸を入れても水素は発生しません。そのかわり、うすい塩酸を入れると卵が腐ったような臭いがする(腐卵臭)、硫化水素という有毒な気体が発生します。
吸いすぎると命の危険もありますので、換気を十分に行うようにしましょう。
| 加熱前の物質 | 加熱後の物質 | |
| 物質名 | 鉄と硫黄 | 硫化鉄 |
| 磁石を近づける | 引き合う | 引き合わない |
| 水に入れる | 硫黄が浮く | 全て沈む |
| うすい塩酸を入れる | 水素が発生する | 硫化水素が発生 |
鉄の硫化と質量の計算問題
鉄と硫黄の化合に関する問題では、質量の計算問題もあわせて出題されるパターンが多いようです。中でもどちらか一方の物質が完全に反応しなくて残ってしまう問題が出題されます。
解説)鉄と硫黄は質量比7:4で反応することがわかります。ということは鉄14gをすべて反応させるには、
7:4=14:x
x=8
8.0gの硫黄の粉末が必要になります。しかし、硫黄の粉末は6.0gしかありませんので、鉄はすべて反応せず、一部が残ってしまいます。
硫黄の粉末は6.0gあるので、
7:4=x:6
x=10.5
14gある鉄のうち10.5gだけが硫黄と反応することがわかります。したがって反応せずに残る物質は鉄で、
14ー10.5=3.5
3.5gの残ることがわかります。
できる硫化鉄は、反応する鉄と硫黄の質量を足し合わせて、
10.5+6.0=16.5
16.5g生じることもわかります。
反応せずに残る物質:鉄3.5g 硫化鉄:16.5g
このように過不足が生じる計算問題もよく見かけますので、何回か練習ししっかりマスターしてください。
対策問題 【定期テスト対策問題】鉄と硫黄の化合


コメント