中学2年理科とそれから発展内容を中3理科で習います。今日は化学変化の分解の中でも、水の電気分解について学習します。陽極、陰極のどちらから何の気体が発生するのかをしっかりと覚えましょう。
【中2理科】水の電気分解
物質に電圧をかけ、電流を流すことで物質を分解することを電気分解といいます。中学2年生では、水の電気分解を学習します。水を電気分解すると、次のような化学変化が起きます。
水→水素+酸素
ここで大事なのは、どちらの電極からどの気体が、どれくらいの量発生するかです。ここを頑張って覚えましょう。
❷陰極…水素が発生!
酸素は線香の火を近づけると炎をあげて激しく線香を燃えさせる気体で水素はマッチの火を近づけると音を立てて燃える気体です。
水の電気分解の覚え方
水の電気分解とくれば、「用意ドン!1・2・3・4‼」と覚えておきましょう。これを覚えているだけで、どっちの極に何対何で気体が発生するかを理解できます。
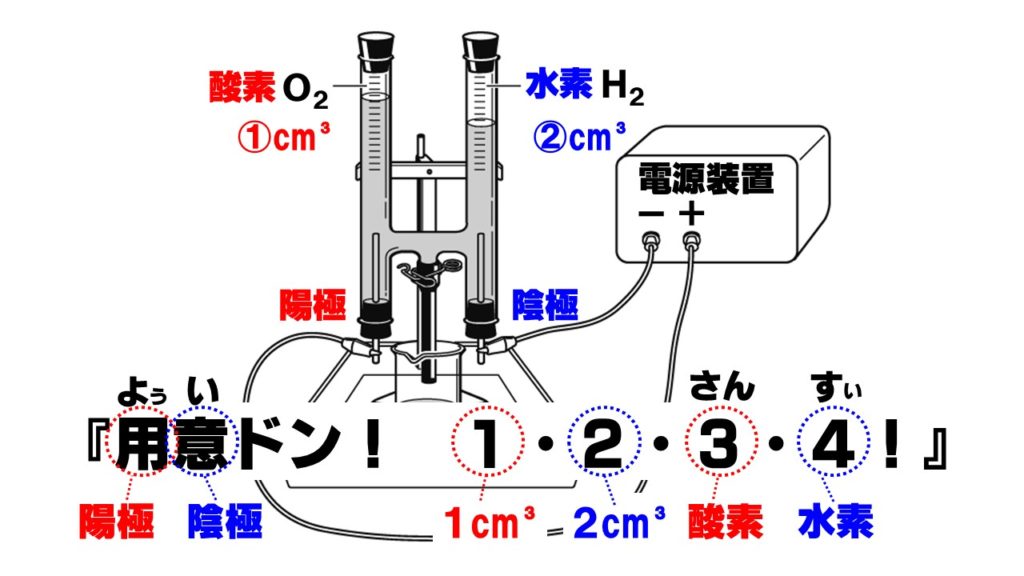
交互に電気分解の図に当てはめていくと、
陽極 陰極
❶cm³ ❷cm³
酸素 水素
と、何極から、どの気体が何対何で発生するかがわかります。
水酸化ナトリウムを溶かす理由
水を電気分解する前に、水酸化ナトリウムを水に溶かします。この理由も答えないといけないので覚えましょう。実は純粋な水には電流が流れません。水酸化ナトリウムを水に溶かし、水酸化ナトリウム水溶液にすることで、電流が流れやすくなります。
電流が流れやすくなると、小さな電圧で電気分解を進めることができるのです。記述は次のうちどれを書いてもOKです。
❷純粋な水には電流が流れないから。
❸水に電流が流れやすくするため。
水の電気分解の化学反応式
まずは、登場する物質の化学式を覚えましょう。化学式とは、物質を原子の記号と数字を使って表したものです。絶対に覚えてください!
- 水…H₂O
- 水素…H₂
- 酸素…O₂
次に化学反応式をつくります。
- 水→水素+酸素
H₂O→H₂+O₂
両辺の原子の数が等しくなるように係数をつけると、
2H₂O→2H₂+O₂
水の電気分解の手順
実験の手順を聞いてくる場合もあります。ポイントはピンチコックの操作方法です。次の手順で実験の準備を行います。
- H字管にゴム栓が付いた電極をとり付ける。
- ピンチコックを閉じる。
- 水酸化ナトリウムを溶かした水をH字管に入れる。
- H字管の上部にゴム栓をとり付ける。
- ピンチコックを開く。
- 電流を流し電気分解する。
発生した気体を調べるときは、ピンチコックを閉じた状態でゴム栓を開けます。以上が水の電気分解のポイントになります。
【中3理科】水の電気分解をイオンで考える
水の電気分解を行っているとき、水溶液中のイオンや分子はどのように移動しているのでしょうか。水を電気分解するために、水酸化ナトリウム水溶液を水に溶かしました。したがって、水酸化ナトリウムNaOHが電離して、次のようなイオンがあります。
- 水酸化ナトリウム→ナトリウムイオン+水酸化物イオン
NaOH→Na⁺+OH⁻
陽極での変化
水酸化ナトリウムを溶かした水を電気分解しているとき、陽極では次のような反応が起こっています。
4OH→O₂+2H₂O+4e⁻
水溶液中にあるイオンはNa⁺とOH⁻です。陽極に引き寄せられるのは、マイナスの電気を帯びた水酸化物イオンOH⁻になります。
陽極に引き寄せられた水酸化物イオンOH⁻は陽極に電子e⁻を渡し、酸素と水が発生します。電子は導線を通って陰極の方に移動します。
陰極での変化
水酸化ナトリウムを溶かし水を電気分解しているとき、陰極では次のような反応が起こっています。
4H₂O+4e⁻→2H₂+4OH⁻
導線を通って移動してきた電子が陰極にたまります。水溶液中にあるナトリウムイオンNa⁺はイオン化傾向が大きく、非常に電子を受けとりにくいイオンです。なので、水H₂Oが陰極から電子を受けとって水素が発生します。
水の電気分解の化学反応式
上記の2つの式を足し合わせてみると、
(4OH⁻→O₂+2H₂O+4e⁻) + (4H₂O+4e⁻→2H₂+4OH⁻)
2H₂O→2H₂+O₂
となります。
対策問題 【定期テスト対策問題】水の電気分解



コメント