化学変化と質量の計算問題に挑戦します。まずは典型的な計算パターンを演習し、次にすべての計算パターンを網羅します。
【対策問題】化学変化と質量の計算特訓
銅やマグネシウムの酸化、鉄の硫化、酸化銅の還元、気体の発生などが主な計算問題の題材として使われます。後半に行くにしたがって計算のレベルが上がっていきますので、まずは最初の問題から挑戦しましょう。
1.銅の酸化
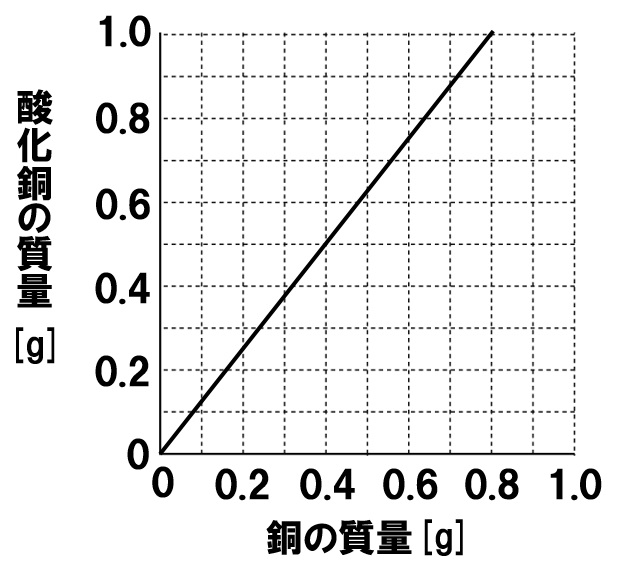 銅粉をステンレス皿にとり、空気中で十分に加熱したところ酸化銅が得られた。右のグラフは、このときの銅の質量と加熱後にできる酸化銅の質量の関係を表したものである。これについて、次の各問いに答えよ。
銅粉をステンレス皿にとり、空気中で十分に加熱したところ酸化銅が得られた。右のグラフは、このときの銅の質量と加熱後にできる酸化銅の質量の関係を表したものである。これについて、次の各問いに答えよ。
(1)0.8gの銅を空気中で加熱すると、何gの酸素が化合するか。
(2)2.0gの銅を空気中で加熱すると、何gの酸化銅ができるか。
(3)1.2gの銅を空気中で加熱すると、何gの酸素が化合するか。
(4)銅と酸素は、どのような質量の割合で化合するか。簡単な整数比で答えよ。
2.マグネシウムの酸化
下の表は、色々な質量のマグネシウムを空気中で十分に加熱し、得られた酸化マグネシウムの質量との関係を表したものである。これについて、次の各問いに答えよ。
| マグネシウムの質量[g] | 0.15 | 0.30 | 0.45 | 0.60 |
| 酸化マグネシウムの質量[g] | 0.25 | 0.50 | 0.75 | 1.00 |
(1)1.80gのマグネシウムを空気中で加熱すると、何gの酸化マグネシウムができるか。
(2)酸化マグネシウム2.50gを得るには、何gのマグネシウムを加熱すればよいか。
(3)0.90gのマグネシウムを完全に加熱すると、質量は何g増加するか。
(4)マグネシウムと酸素は、どのような質量の割合で化合するか。簡単な整数比で答えよ。
3.銅の酸化と加熱回数
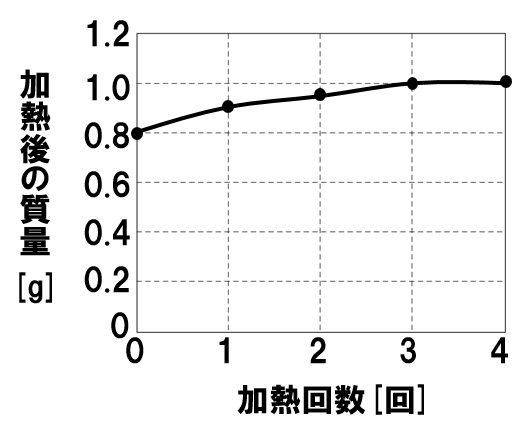 銅の粉末0.8gをステンレス皿に入れて一定時間加熱し、質量をはかる操作を繰り返し行った。右のグラフはこのときの結果を示したものである。これについて、次の各問いに答えなさい。
銅の粉末0.8gをステンレス皿に入れて一定時間加熱し、質量をはかる操作を繰り返し行った。右のグラフはこのときの結果を示したものである。これについて、次の各問いに答えなさい。
(1)0.8gの銅粉が、空気中の酸素と完全に反応したのは、加熱回数が何回目のときか。
(2)0.8gの銅粉を、空気中の酸素と完全に反応させた場合、何gの酸素が化合するか。
(3)1回目の加熱後には、加熱後の質量が0.9gになっていた。このとき未反応の銅粉の質量を求めよ。
4.同じ質量の酸素と化合する金属の比
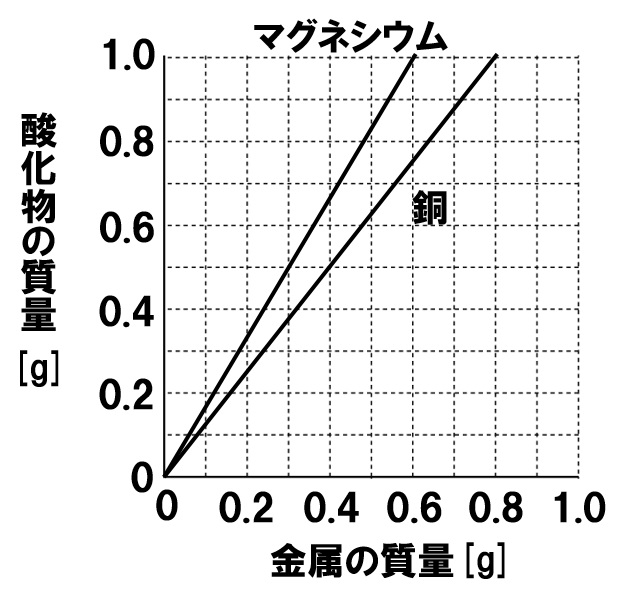 右のグラフは、2種類の金属である銅とマグネシウムを、空気中で加熱したときにできる酸化物との質量の関係を表したグラフである。これについて、次の各問いに答えよ。
右のグラフは、2種類の金属である銅とマグネシウムを、空気中で加熱したときにできる酸化物との質量の関係を表したグラフである。これについて、次の各問いに答えよ。
(1)グラフより、銅と酸素が反応するときの質量の比を、整数で答えよ。
(2)グラフより、マグネシウムと加熱後にできる酸化マグネシウムの質量の比を、簡単な整数比で答えよ。
(3)同じ質量の酸素と化合する、銅とマグネシウムの質量の比を答えよ。
(4)同じ質量の金属と化合する酸素の質量の比を、銅と化合する酸素の比:マグネシウムと化合する酸素の比で答えよ。
5.過不足がある質量の計算(鉄の硫化)
鉄粉7.0gと硫黄の粉末4.0gを混ぜて、ガスバーナーで加熱したところ、過不足なく反応しすべて黒色の硫化鉄になった。これについて、次の各問いに答えよ。
(1)鉄粉14gと硫黄の粉末6.0gを混ぜてガスバーナーで加熱すると、一方の物質の一部が反応せずに残った。反応せずに残った物質は何か。物質名で答えよ。また、何g反応せずに残るか。
(2)(1)のときにできる硫化鉄は何gか。
(3)(1)で反応せずに残った物質を完全に反応させるためには、どの物質が何g必要か。
6.気体の発生
うすい塩酸30cm³を入れた容器の質量を電子てんびんにのせ、反応前の質量を測定した。次に、石灰石の質量をいろいろと変えながら、電子てんびんの上のうすい塩酸に入れていった。表はこのときの、入れた石灰石の質量と、反応前、反応後の質量をまとめたものである。これについて、あとの各問いに答えなさい。
| 石灰石の質量[g] | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 |
| 反応前の質量[g] | 90.0 | 92.0 | 93.0 | 94.0 | 95.0 |
| 反応後の質量[g] | 89.7 | 91.4 | 92.1 | 92.8 | 93.8 |
(1)うすい塩酸30cm³が過不足なく反応する石灰石の質量は何gか。
(2)(1)のとき、発生する気体の質量は何gか。
(3)同じ濃度のうすい塩酸45cm³と過不足なく反応する石灰石は何gか。また、何gの気体が発生するか。
(4)同じ濃度のうすい塩酸60cm³と石灰石10gを入れたとき、どちらが何g反応せずに残るか。
【解答・解説】化学変化と質量の計算特訓
化学変化の計算問題は、ほとんどが比例に関する問題です。一方の物質が2倍・3倍になると、もう一方の物質も2倍、3倍になるという問題がほとんどです。比例式をうまく立てて計算できるようになりましょう。
1.銅の酸化
(1)0.2g
グラフより、0.8gの銅を加熱すると、1.0gの酸化銅ができることがわかります。銅に化合した酸素は、
1.0-0.8=0.2
(2)2.5g
0.4gの銅を加熱すると0.5gの酸化銅ができていることがわかります。このとき化合した酸素は0.1gなので、銅と酸素とできる酸化銅の質量比は、
銅:酸素:酸化銅=4:1:5
であるとわかります。銅2.0gを加熱して何gの酸化銅ができるか聞いているので、
4:5=2.0:x
x=2.5
(3)0.3g
銅:酸素:酸化銅=4:1:5なので、1.2g銅を加熱したときに化合する酸素は、
4:1=1.2:x
x=0.3
(4)4:1
グラフより、銅と化合してできる酸素の質量比は4:1であるとわかります。
2.マグネシウムの酸化
(1)3.00g
表より0.60gのマグネシウムを加熱すれば、1.00gの酸化マグネシウムができるとわかります。1.80gのマグネシウムは0.60gの3倍なので、できるさ酸化マグネシウムも3倍の3.00gになります。
(2)1.50g
表より0.50gの酸化マグネシウムをつくるには、0.30gのマグネシウムが必要であるとわかります。2.50gのマグネシウムは0.50gの5倍なので、必要なマグネシウムも5倍の1.50g必要であるとわかります。
(3)0.60g
表より0.30gのマグネシウムを加熱すると、質量は0.20g増加していることがわかります。0.90gのマグネシウムは0.30gの3倍なので、質量の増加も3倍の0.60gになるとわかります。
(4)3:2
表より0.30gのマグネシウムを加熱すると、0.20gの酸素が化合することがわかるので、
マグネシウム:酸素=0.30:0.20=3:2
3.銅の酸化と加熱回数
(1)3回目
グラフより、加熱回数が3回目より質量の増加がありません。したがって、3回目の加熱で銅がすべて酸化銅に変わったことがわかります。
(2)0.2g
0.8gの銅を加熱すると、加熱後の質量が1.0gになっていることがわかります。このとき化合した酸素は、
1.0-0.8=0.2
(3)0.4g
1回目の加熱後の質量が0.9gであることから、このとき化合した酸素は、
0.9-0.8=0.1
銅:酸素=4:1の質量比で反応するので、酸素が0.1g化合したとき、反応した銅は、
4:1=x:0.1
x=0.4
したがって未反応の銅は、
0.8-0.4=0.4
4.同じ質量の酸素と化合する金属の比
(1)4:1
グラフより0.4gの銅を加熱すると0.5gの酸化銅ができるとわかります。このとき化合した酸素は0.1gなので、
銅:酸素=0.4:0.1=4:1
(2)3:5
グラフより0.3gのマグネシウムを加熱すると0.5gの酸化マグネシウムができることがわかります。したがって、
マグネシウム:酸化マグネシウム=0.3:0.5=3:5
(3)8:3
銅:酸素=4:1、マグネシウム:酸素=3:2の質量比で反応します。同じ質量の酸素と化合する金属の質量比をきいているので、酸素の比を最小公倍数の2でそろえると、
銅:酸素=8:2、マグネシウム:酸素=3:2、したがって、
銅:マグネシウム=8:3
(4)3:8
銅:酸素=4:1、マグネシウム:酸素=3:2の質量比で反応します。同じ質量の金属と化合する酸素の質量比をきいているので、金属の比を最小公倍数の12でそろえると、
銅:酸素=12:3、マグネシウム:酸素=12:8、したがって、
銅と化合する酸素:マグネシウムと化合する酸素=3:8
5.過不足がある質量の計算(鉄の硫化)
(1)物質名:鉄粉 質量:3.5g
問題文より、鉄と硫黄の反応比が7:4であることから、7.0gの2倍の14gの鉄粉をすべて反応させるには、4.0gの2倍の8.0gの硫黄が必要であるとわかります。しかし、硫黄の粉末は6.0gしかないので、鉄粉はすべて反応しません。硫黄6.0gはすべて反応するので、化合する鉄は、
7:4=x:6.0
x=10.5
反応せずに残る鉄の質量は、
14-10.5=3.5
(2)16.5g
(1)より、10.5gの鉄粉と6.0gの硫黄の粉末が反応するとわかったので、
10.5+6.0=16.5
(3)物質名:硫黄 質量:2.0g
(1)より、未反応の鉄の質量は3.5gなので、これと過不足なく反応する硫黄は、
7:4=3.5:x
x=2.0
6.気体の発生
(1)4.0g
表より、石灰石の質量が1.0g、2.0g、3.0g、4.0g、5.0gのとき、発生する二酸化炭素の質量は、それぞれ、90.0-89.7=0.3g、92.0-91.4=0.6g、93.0-92.1=0.9g、94.0-92.8=1.2g、95.0-93.8=1.2gであるとわかります。石灰石4.0gを反応させたときから、発生する二酸化炭素の質量が1.2gで変わらなくなっていることから、うすい塩酸30cm³と過不足なく反応する石灰石は4.0gであるとわかります。
(2)1.2g
(1)より、石灰石4.0gを反応させたときに発生する二酸化炭素は、
94.0-92.8=1.2
(3)石灰石:6.0g 気体:1.8g
問題の実験より、うすい塩酸と石灰石と発生する二酸化炭素の比は、
うすい塩酸:石灰石:二酸化炭素=30cm³:4.0g:1.2g
うすい塩酸が30cm³の1.5倍の45cm³あるので、石灰石も二酸化炭素も1.5倍になります。
石灰石:4.0×1.5=6.0
二酸化炭素:1.2×1.5=1.8
(4)石灰石が2.0g残る。
うすい塩酸と石灰石の反応比は、
うすい塩酸:石灰石=30cm³:4.0g
うすい塩酸が2倍の60cm³あるので、反応する石灰石も2倍の8.0gになります。したがって、反応せずに残る石灰石は、
10-8.0=2.0



コメント