酸化銅の還元に関する問題演習を行います。還元されてできた物質、酸化されてできた物質の性質を確認しましょう。
ポイント 【中2理科】酸化銅の還元のポイント
【対策問題】酸化銅の還元の実験
下の図のように、酸化銅の粉末4.0gと炭素の粉末0.3gの混合物を試験管に入れ、ガスバーナーで加熱する実験を行った。加熱を続け、気体が発生しなくなったら、①ガラス管の先を石灰水からとり出し、加熱をやめて、②ピンチコックでゴム管を閉じた。試験管が冷えてから、中の物質を取り出して質量を測定した。これについて、次の各問いに答えよ。ただし、試験管内の物質はたがいに完全に反応し、過不足は生じなかったのとする。
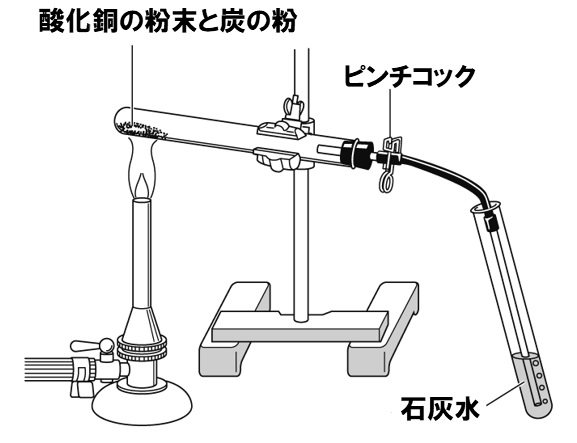
(1)実験のように、固体を加熱する場合、試験管の口の方を少し下げて加熱する理由を、簡潔に答えよ。
(2)問題文中の下線部①のように、ガスバーナーの火を止める前にガラス管の先を石灰水からとりだす理由を、簡潔に答えよ。
(3)問題文中の下線部②のように、加熱をやめた後、ピンチコックでゴム管を閉じる理由を、簡潔に答えよ。
(4)加熱後、試験管にはある物質が残った。この物質の示す性質として、最も適切なものを、下のア~エからすべて選び、記号で答えよ。
ア 磁石につく。
イ 電気をよく通す。
ウ みがくと特有の光沢がでる。
エ 白色である。
(5)この実験で、発生した気体は何gか。ただし、銅と酸素が反応するときの質量比は4:1であるとする。
(6)この実験で起こった化学変化を、化学反応式で書け。
(7)この実験で、酸化銅に起こった化学変化を何というか。
(8)この実験で、酸化されてできた物質は何か。
【解答・解説】酸化銅の還元の実験
(1)発生した液体が加熱部に流れ、試験管が割れるのを防ぐため。
固体を加熱する実験を行う場合、液体の水などが発生する可能性があります。発生した液体が加熱部に流れると、試験管が割れる可能性があります。
(2)石灰水の逆流を防ぐため。
ガラス管を石灰水に入れたままガスバーナーの火を止めると、試験管が次第に冷え、試験管内の気圧が下がり、石灰水が逆流し試験管が割れる恐れがあります。
(3)試験管内の銅が、空気中の酸素と反応しないようにするため。
ガラス管を石灰水からとりだしガスバーナーの火を止めると、その後試験管が冷え、試験管内に空気が入ってきます。試験管には還元されてできた銅があるので、空気中の酸素と反応し、再び酸化銅になってしまいます。
(4)イ、ウ
加熱後、試験管内には銅ができています。銅は金属なので、金属の性質を選んでください。磁石につくのは、鉄だけの性質なので選ばないように。また、銅の色は赤褐色です。
・展性・延性がある。
・熱や電気をよく通す。
(5)1.1g
銅と酸素の化学変化の質量比は、銅:酸素:酸化銅=4:1:5になります。
4.0gの酸化銅がすべて還元されると、生じる銅は、
4:5=x:4.0 x=3.2
質量保存の法則より、
酸化銅4.0g+炭素0.3g=銅3.2g+二酸化炭素1.1g
(6)2CuO+C→2Cu+CO₂
酸化銅を炭素で還元すると、銅と二酸化炭素が生じます。化学式を間違えないようにしましょう。また、右辺と左辺を=でつながないように。化学変化の前後で、物質の性質が変化するので、→を使うこと。
(7)還元
酸化銅のような酸化物から、酸素を取り去る化学変化を還元といいます。還元が起こるときには同時に酸化が起こることも覚えておきましょう。
(8)二酸化炭素
酸化銅が還元される反応の裏では、炭素が酸化される反応が起こっています。炭素が酸化されてできる物質は二酸化炭素です。


コメント