【定期テスト対策問題】酸化銅の還元の計算問題です。
ポイント 【中2理科】酸化銅の還元のポイント
【対策問題】酸化銅の還元の計算
下の図のように、酸化銅4.0gと炭素の粉末を混ぜ合わせて、二酸化炭素が発生しなくなるまで加熱した後、試験管内に残った固体とその質量を調べた。グラフは、混ぜ合わせる炭素の質量をいろいろに変えて調べ、その結果を表したものである。次の各問いに答えなさい。
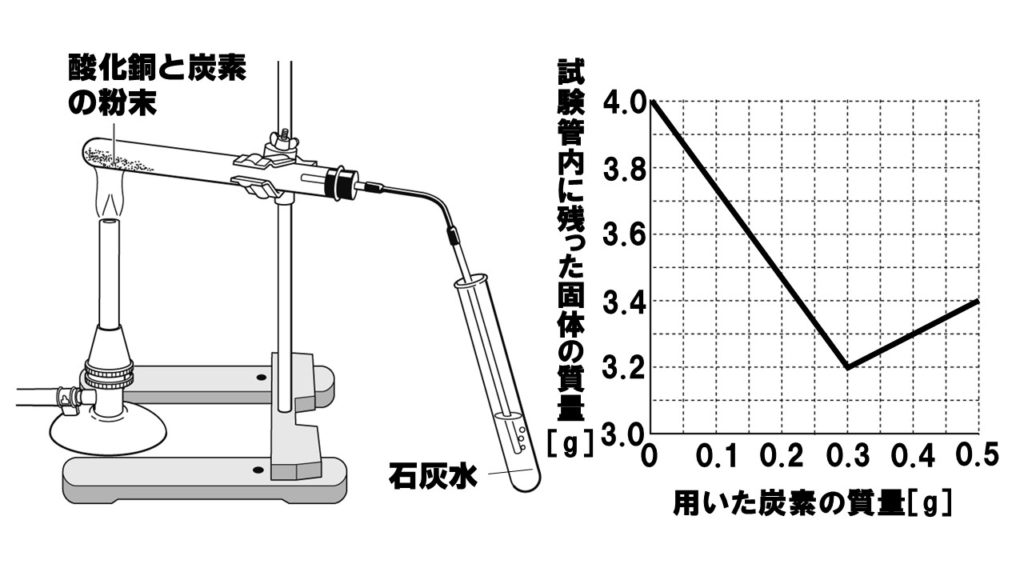
(1)酸化銅と炭素の粉末を加熱したときの化学変化を、化学反応式で表せ。
(2)酸化銅4.0gは何gの炭素とちょうど反応したか。
(3)(2)のとき試験管に残った物質の色は何色か。また、その質量は何gか。
(4)(2)のとき発生した二酸化炭素の質量は何gか。
(5)酸化銅をつくっている銅と酸素の質量の比を、最も簡単な整数の比で表せ。
(6)1.6gの銅をつくるために、酸化銅と炭素は少なくとも何g必要か。
【解答・解説】酸化銅の還元の計算
(1)2CuO+C→2Cu+CO₂
酸化銅と炭素を混ぜて加熱すると、酸化銅が還元されて銅に、炭素は酸化されて二酸化炭素になります。
(2)0.3g
グラフより、加熱後の試験管内の物質の質量が一番小さくなったところで、完全に還元が終了しています。つまり、酸化銅4.0gをすべて還元し銅にするには、0.3gの炭素が必要だとわかります。
(3)赤色、3.2g
試験管内に残った物質の質量が一番小さくなったとき、酸化銅が完全に還元され、試験管内には銅だけが残ります。したがって銅の質量は3.2gになります。
(4)1.1g
質量保存の法則より。
酸化銅4.0g+炭素0.3g=銅3.2g+二酸化炭素xg
したがって、発生する二酸化炭素の質量は1.1gとなります。
(5)4:1
還元で得られた銅の質量は3.2g、このとき外れた酸素は4.0-3.2=0.8g。
3.2:0.8=4:1
(6)酸化銅2.0g、炭素0.15g
実験では3.2gの銅が得られています。今回は、その半分の1.6gの銅を得ればいいので、必要な酸化銅も炭素も半分の量で済みます。
酸化銅は、4.0÷2=2.0
炭素は、0.3÷2=0.15
酸化銅の還元のグラフ
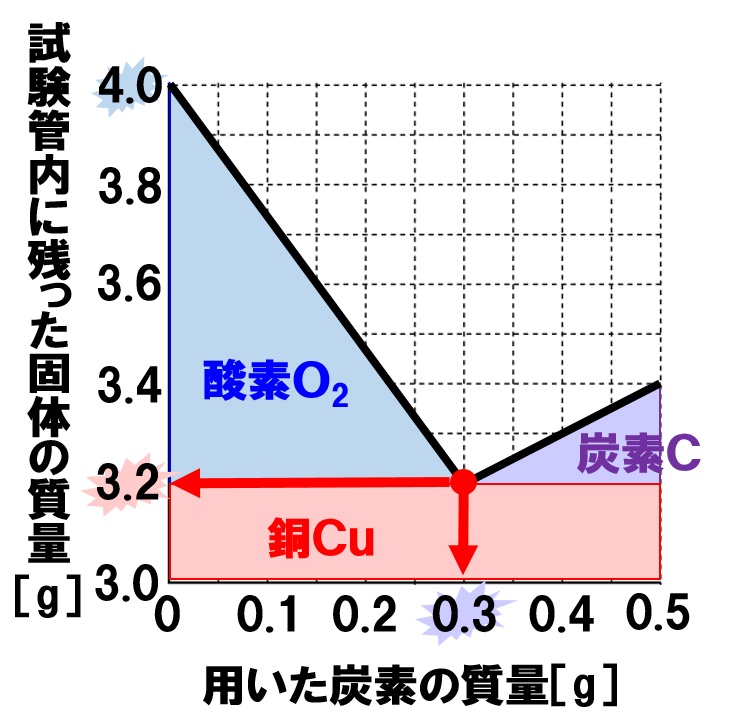
グラフの青の領域は、還元によって外れる酸素の量を表しています。また、赤の領域は銅の質量、紫の領域は、使われずに余った炭素の質量を表しています。



コメント