【定期テスト対策問題】塩酸の電気分解の問題です。
ポイント 【中3理科】塩酸の電気分解のポイント
【問題】塩酸の電気分解の問題
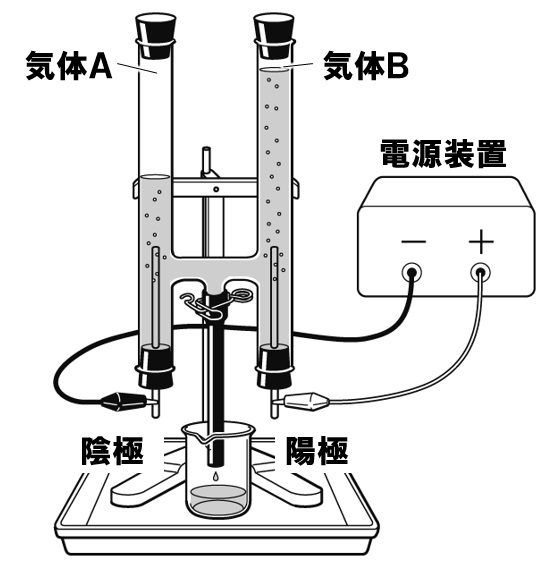 右図は、塩酸を電気分解したようすを表した図である。これについて、次の各問いに答えなさい。
右図は、塩酸を電気分解したようすを表した図である。これについて、次の各問いに答えなさい。
(1)塩酸の溶質は何か。名称を答えなさい。
(2)陰極に発生した気体Aを調べる方法とその結果を、陰極に発生する気体の名称を用いて、簡潔に答えなさい。
(3)陽極にたまった気体Bは、陰極にたまった気体Aよりも体積が少なくなっている。これは、気体Bにある性質があるからである。この性質を、陽極に発生する気体の名称を用いて、簡潔に答えなさい。
(4)陽極に発生する気体Bの性質として正しいものを、次のア~エから一つ選び、記号で答えなさい。
ア 空気よりも密度が小さい。
イ 水に溶けるとアルカリ性を示す。
ウ 無色透明である。
エ 赤インクをしみ込ませたろ紙を近づけると白くなる。
(5)塩酸の電気分解で起こった化学変化を、化学反応式で書け。
(6)次の文は、塩酸に電圧をかけたときのイオンの移動についてまとめたものである。文中の( )に適する語句を入れなさい。
【解答・解説】塩酸の電気分解の解答
(1)塩化水素
溶質とは水に溶けている物質のことです。塩酸の溶質は塩化水素で、刺激臭がする気体です。
・塩酸は水と塩化水素の混合物である!
(2)マッチの火を近づけると、水素が音を立てて燃える。
塩酸の電気分解で、陰極から発生する気体は水素H₂になります。水素は、マッチの火を近づけると、音を立てて燃え、燃えた後は水ができます。
・塩素…赤インクを染み込ませたろ紙を近づけると、色が抜けて白くなる!
(3)塩素は水に溶けやすいから。
塩酸の電気分解で、陽極から発生する気体は塩素Cl₂になります。陰極で発生する水素も、陽極で発生する塩素も、実は同じ体積発生しています。しかし、塩素は水に溶けやすいという性質があるので、発生した気体が水に溶け少なくなっているのです。
❶黄緑色で刺激臭(プールのにおい)の気体!
❷水によく溶け、溶けると酸性を示す!
❸空気より密度が大きいので、下方置換法で集める!
❹殺菌作用・漂白作用がある!
(4)エ
陽極から発生する気体は塩素Cl₂には、次のような性質があります。
①黄緑色の気体
②刺激臭(プールの臭い)
③水に溶けやすく、溶けると酸性を示す
④空気よりも密度が大きい(重い)
⑤殺菌作用
⑥脱色作用
(5)2HCl→H₂+Cl₂
塩酸を電気分解すると、陰極から水素H₂、陽極から塩素Cl₂が発生します。
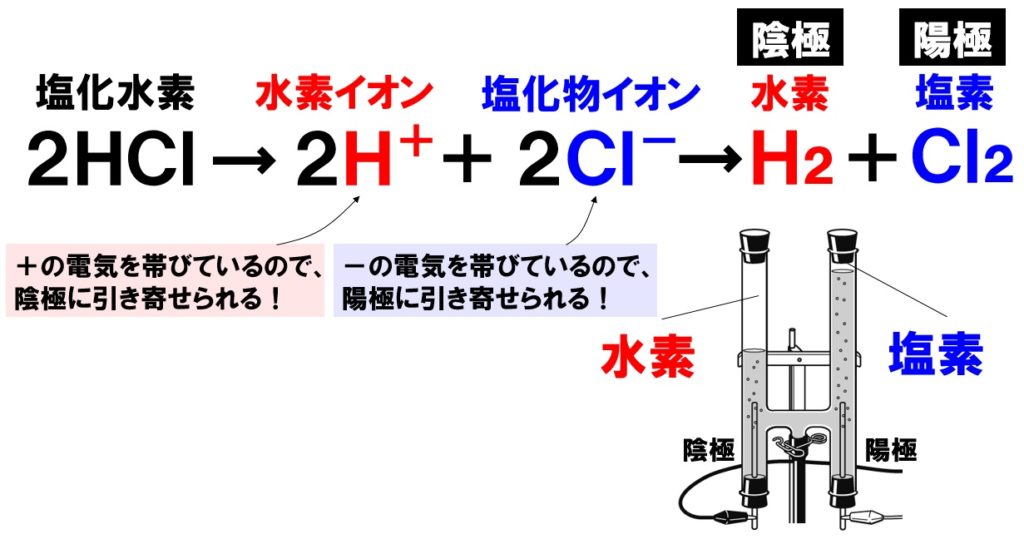
(6)①塩化物 ②失って ③水素 ④受け取って
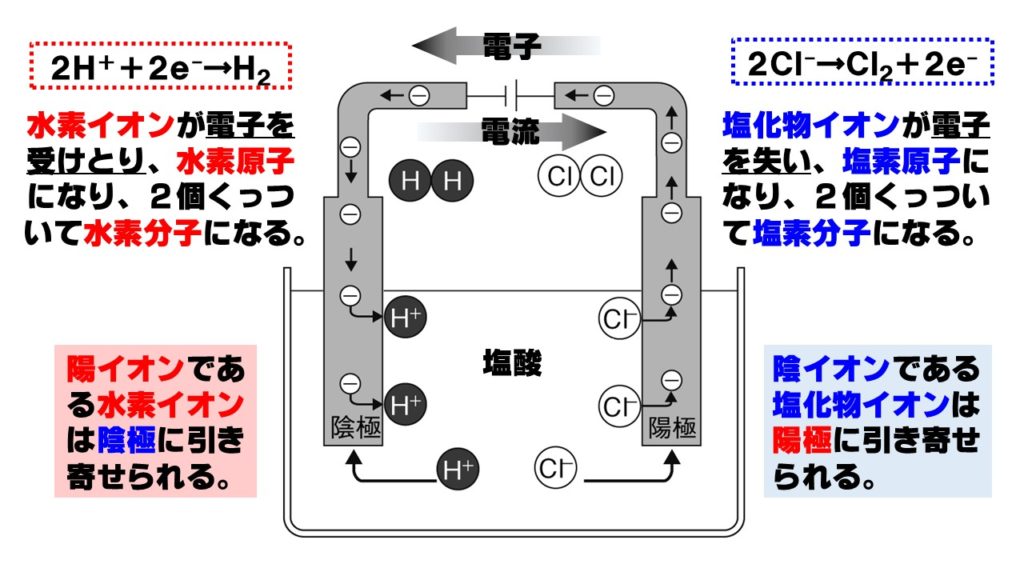
塩化水素HClを水に溶かすと、水素イオンH⁺と塩化物イオンCl⁻に電離します。塩化物イオンはCl⁻は、マイナスの電気を帯びているので、陽極に引き寄せられ、陽極で電子を失い塩素原子に戻ります。一方の水素イオンH⁺は、プラスの電気を帯びているので、陰極に引き寄せられ、陰極で電子を受けとり水素原子に戻ります。


コメント