イオンと化学変化で学習する、塩酸の電気分解について学習します。陽極と陰極から何が発生するのか覚えて、さらになぜその物質が出てくるのか理由まで理解しましょう。
塩酸の電気分解
塩酸の電気分解を理解するには、次の内容を順序だてて覚えていく必要があります。
- 塩酸は気体の塩化水素が溶質である。
- 塩化水素の電離のようすを理解する。
- 陽極と陰極での電気分解を理解する。
- 発生した物質の性質を理解する。
まず、第1段階として、塩酸は水溶液で、気体の塩化水素が水に溶けているということをしっかりと理解しておきましょう。いい方を変えると、塩酸の溶質は塩化水素であるということです。
次は、気体の塩化水素が水に溶けてどのように電離するかを覚えます。電離とは陽イオンと陰イオンに分かれることでしたね。
塩化水素の電離
塩酸は、気体の塩化水素を水に溶かしてできる水溶液です。したがって、塩酸は気体の塩化水素と水の混合物になります。まずは、塩化水素が水に溶け、電離するようすを確認しましょう。
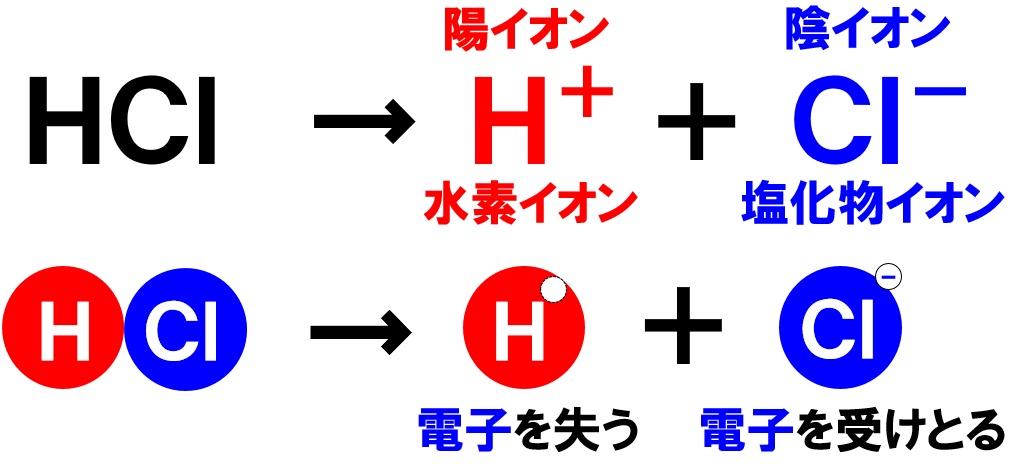
塩化水素の化学式はHClです。塩化水素が水に溶けると、水素原子Hが電子を1つ失い、陽イオンである水素イオンH⁺に、塩素原子Clは電子を1つ受けとり、陰イオンの塩化物イオンCl⁻になります。このとき生じる水素イオンH⁺と塩化物イオンCl⁻の比は1:1になります。
このように、気体の塩化水素が水に溶け、水溶液中に水素イオンH⁺と塩化物イオンCl⁻が存在している水溶液が塩酸になります。
後で詳しく学習しますが、塩酸は酸性の水溶液です。なぜ酸性になるのかというと、水溶液中に水素イオンH⁺が存在するからです。塩化水素のように水に溶けて水素イオンH⁺が出てくると、その水溶液は酸性になるのです。
❷塩酸は塩化水素と水の混合物!
❸塩酸の中には水素イオンH⁺と塩化物イオンCl⁻が1:1で存在する!
❹塩酸は酸性の水溶液!酸性の正体は水素イオンH⁺
塩酸の電気分解
塩酸に電極を差し込み電流を流すと、塩酸が電気分解され、陰極から水素H₂、陽極から塩素Cl₂が発生します。これは、塩酸中の陽イオンである水素イオンH⁺が陰極に、陰イオンである塩化物イオンCl⁻が陽極に引き寄せられるためです。
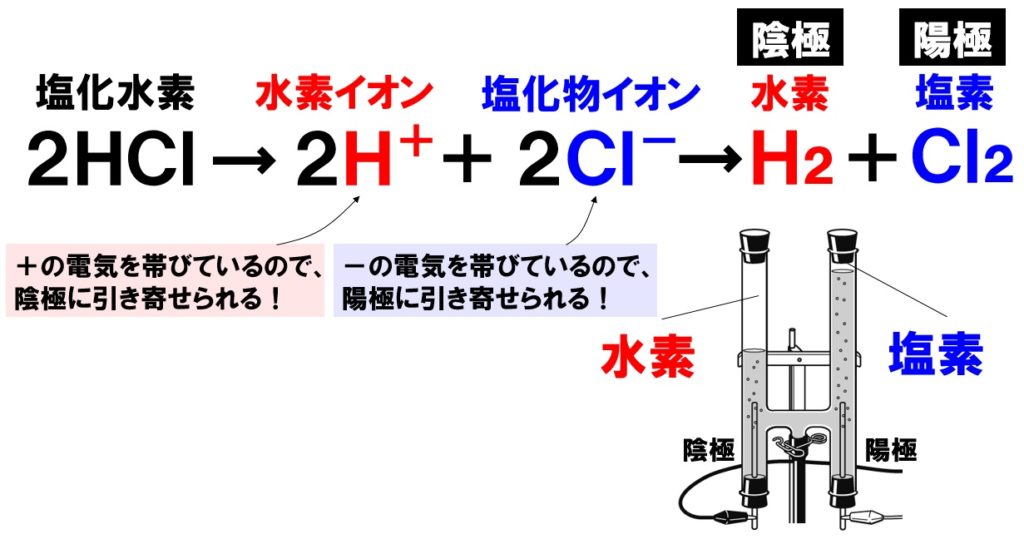
陰極から発生する水素と、陽極から発生する塩素の体積は同じですが、実際には陽極から発生する塩素の方が少なくなります。理由は、塩素が水に溶けやすいからです。発生しても塩素は水に溶けるので、実際の量よりも少なくなります。
塩酸の電気分解の化学反応式
塩酸(塩化水素の水溶液)HClを電気分解すると、陰極から水素H₂、陽極から塩素Cl₂が発生するので、次の化学反応式が書けます。
- 塩酸→水素+塩素
- 2HCl → H₂ + Cl₂
塩化水素の電離のようすを表す式と間違えないようしましょう。
・化学反応式:2HCl→H₂+Cl₂
塩酸の電気分解で発生した物質の性質
陰極からは水素、陽極からは塩素が発生しますが、それぞれ次のようにして発生した気体を調べます。
- 水素H₂…マッチの火を近づけると、爆発して水ができる。
- 塩素Cl₂…赤インクをしみ込ませたろ紙を近づけると、色が抜けて白くなる。
水素は燃える気体、塩素には漂白作用があることを利用して気体の判別を行います。あわせて、塩素の性質も覚えましょう。
●塩素の性質
下の表の内容を覚えてください。
| 化学式 | Cl₂ |
| 色 | 黄緑色 |
| 水への溶け方 | よく溶ける |
| 水溶液の性質 | 酸性 |
| 空気と比べた重さ | 重い |
| 集め方 | 下方置換法 |
| 臭い | 刺激臭(プールの臭い) |
| その他 | 殺菌作用、漂白作用 |
❷塩素は水に溶けやすいので、水素よりも少なくなる!
❸塩素は漂白作用がある!
塩酸の電気分解をもっと詳しく
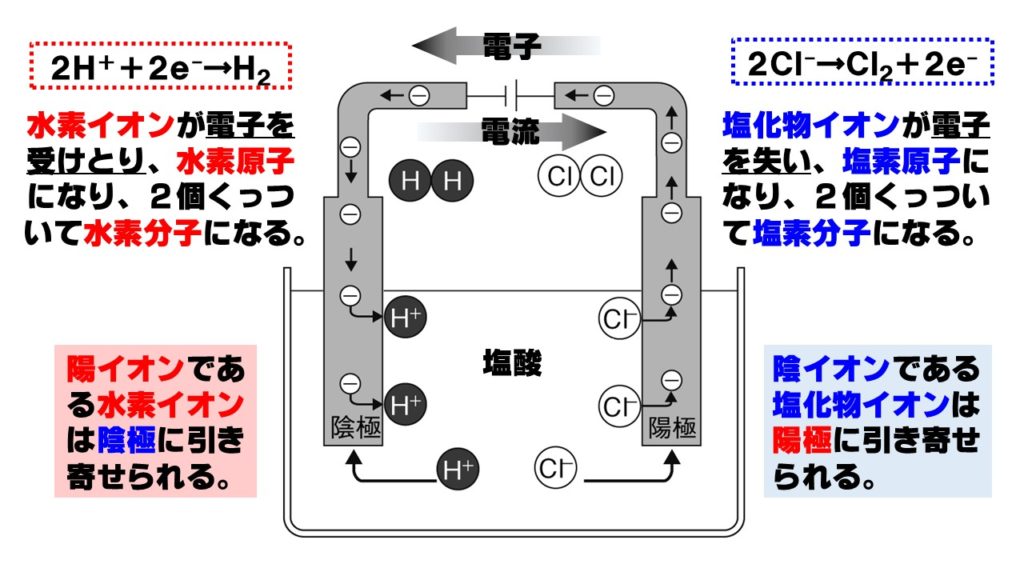
塩酸の電気分解をイオンの動きや、電子の受け渡しまで詳しくみていきましょう。塩酸に電流を流すと、下の図のようなイオンの移動や電子の受け渡しが行われます。
次のような流れで覚えておきましょう。
- 陰イオンである塩化物イオンCl⁻が陽極に引き寄せられる。
- 陽極に引き寄せられた塩化物イオンCl⁻は電子を電極に渡し、塩素原子Clになる。
- 塩素原子Clが2つくっつき、塩素分子Cl₂になって発生する。
- 陽極に渡された電子が、導線を通って陰極に移動する。
- 陽イオンである水素イオンH⁺が陰極に引き寄せられる。
- 導線を通ってやってきた電子を水素イオンH⁺が受けとり、水素原子Hになる。
- 水素原子Hが2個くっついて水素分子H₂になって発生する。
ここまで理解できれば、塩酸の電気分解は完璧です。


コメント