【定期テスト対策問題】原子のつくりです。
ポイント 【中3理科】原子のつくりのポイント
【問題】原子とイオンの問題
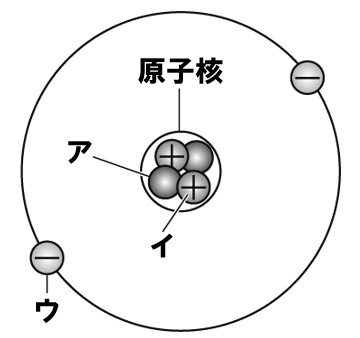 右の図は、原子のつくりを表したものである。原子は図のようにいくつかの粒子が集まってできている。これについて、次の各問いに答えなさい。
右の図は、原子のつくりを表したものである。原子は図のようにいくつかの粒子が集まってできている。これについて、次の各問いに答えなさい。
(1)右の図で、原子核の中にあるアとイの粒子の名称をそれぞれ答えなさい。
(2)右の図で、原子核のまわりを飛んでいる粒子ウは何か。名称を答えなさい。また、ウの粒子について正しく述べているものを次のア~エの中から一つ選び、記号で答えなさい。
ア 同じ原子でも飛んでいる数が異なることがある。
イ 原子をつくっている粒子の中で最も軽い。
ウ 原子から他の原子に移動することはない。
エ マイナスの電気を帯びているが、プラスの電気を帯びることもある。
(3)原子は、全体的に電気を帯びておらず、電気的に中性になっていると表現される。これは、原子の中で、何の粒子と何の粒子の数が等しいからか。粒子の名称を2つ答えよ。
(4)原子がウの粒子を失うと、プラスの電気を帯びた粒子となる。この粒子を何というか。
(5)カルシウムイオンのイオン式はCa2+になる。カルシウム原子の中にあるイの数が20個であるとき、カルシウム原子のウの数と、カルシウムイオンのウの数をそれぞれ答えなさい。
【解答・解説】原子とイオンの解答
(1)ア:中性子 イ:陽子
原子は、+の電気を帯びた原子核と、そのまわりをまわる-の電気を帯びた電子からできています。原子核の中には、+の電気を帯びた陽子と、電気を帯びていない中性子があります。
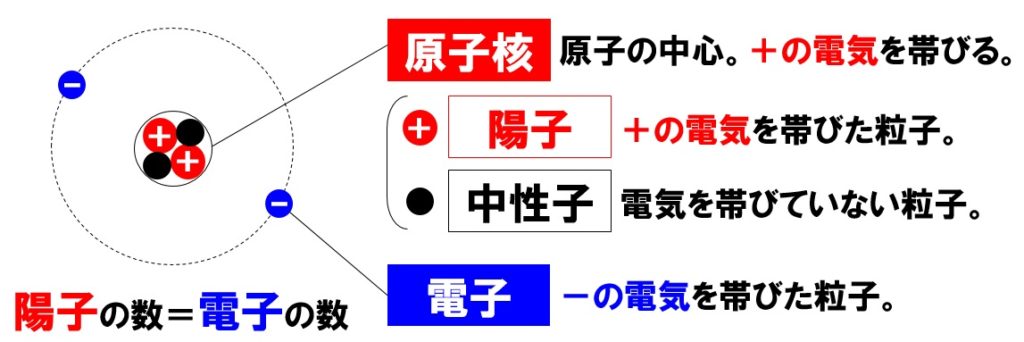
(2)名称:電子 記号:イ
原子核のまわりを飛んでいる粒子は、-の電気を帯びた電子で、原子核の中の陽子や中性子よりも軽い粒子になります。陽子や中性子は、電子の質量の1840倍もあります。
(3)陽子と電子
原子では、+の電気を帯びた陽子と、-の電気を帯びた電子の数が等しくなっており、電気的に中性(+も-も電気を帯びていない状態)になっています。原子が電気を帯びると、名称がイオンに変わります。
(4)陽イオン
原子が-の電気を帯びた粒子である電子を失うと、原子は全体的に+の電気を帯びます。これが陽イオンです。逆に、電子を受けとると-の電気を帯びます。これを陰イオンといいます。
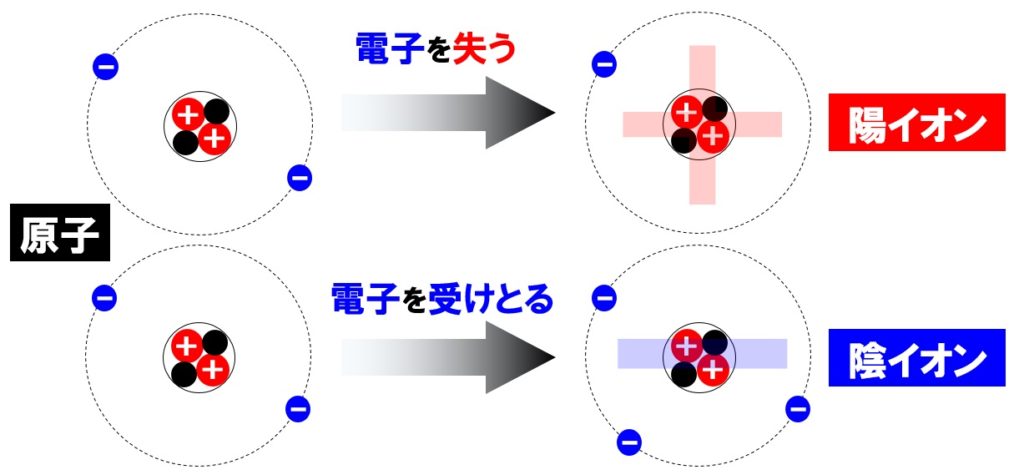
(5)カルシウム原子:20 カルシウムイオン:18
原子では、電子の数と陽子の数が等しくなっています。したがって、カルシウム原子の電子の数は陽子の数と同じ20になります。カルシウムイオンは、電子を2個失ってできる陽イオンです。したがって電子の数は18個になります。
| カルシウム原子Ca | カルシウムイオンCa²⁺ | |
| 陽子の数 | 20個 | 20個 |
| 電子の数 | 20個 | 18個 |



コメント