中学3年で学習する化学分野は化学変化と原子・イオンになります。高校化学に直結する非常に大切な分野になります。今日はイオンを勉強するうえで基礎となる「原子とイオンの違い」をマスターしましょう。さらに、物質がイオンになる現象である電離についても詳しく見ていきます。テストや入試に登場する電解質。非電解質も覚えましょう。
原子のつくり
中学2年生で原子について少し学習しました。簡単に復習すると、原子とは、物質をつくっている最小の粒で、それ以上分解できない粒でした。この原子が何個か結びつくことで分子などができていましたよね。
今日は、原子のつくりをもっと詳しくみていきます。原子を構成する粒子の名前と、それぞれの数の関係を覚えましょう。
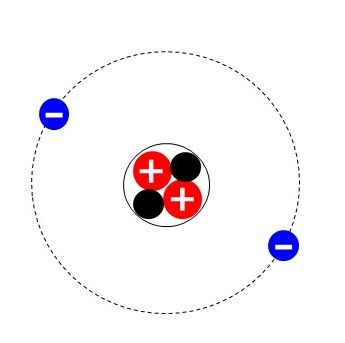
上の図は原子を拡大してみたものです。原子の中心には原子核というつくりがあり、原子核の中には+の電気を帯びた陽子、電気を帯びていない中性子が入っています。
そして、その原子核のまわりを-の電気を帯びた電子という粒子が回っています。
原子番号
原子核の中にある陽子の数で原子の種類が決まります。ですので陽子の数を原子番号といい、原子一つ一つに番号が付けられています。
| 原子番号 | 原子 | 陽子の数 |
| 1 | H 水素 | 1個 |
| 2 | He ヘリウム | 2個 |
| 3 | Li リチウム | 3個 |
| 4 | Be ベリリウム | 4個 |
| 5 | B ホウ素 | 5個 |
| 6 | C 炭素 | 6個 |
| 7 | N 窒素 | 7個 |
| 8 | O 酸素 | 8個 |
| 9 | F フッ素 | 9個 |
陽子の数と電子の数
原子では、必ず、陽子の数と電子の数が同じになっています。プラスの電気を帯びた陽子の数と、マイナスの電気を帯びた電子の数が同じですので、原子全体としては電気を帯びていない状態になります。
この電気を帯びていない状態を「電気的に中性」と言ったりもします。この電気を帯びたいない状態からバランスが崩れ、電気を帯びてしまうと原子ではなくイオンと名称が変わります。
原子のポイント❶陽子は+の電気を帯びている。
❷電子は-の電気を帯びている。
❸中性子は電気を帯びていない。
❹原子全体でみると陽子の数と電子の数が等しいので、原子は電気的に中性である。
❷電子は-の電気を帯びている。
❸中性子は電気を帯びていない。
❹原子全体でみると陽子の数と電子の数が等しいので、原子は電気的に中性である。
対策問題 【定期テスト対策問題】原子のつくり


コメント