中学1年理科。今日のテーマは「溶解度と再結晶」です。ここも計算問題がよく出題されます。溶解度曲線を読み取って、再結晶量の計算や、濃度の計算ができるようになりましょう。
溶解度とは?
溶解度とは、水100gに溶ける物質の質量のことです。物質の種類によっても変わりますし、水の温度によっても変化します。「水100gに溶ける」というところもポイントですのでしっかり覚えておきましょう。
溶解度のポイント!❶水100gに溶ける物質の最大の量
❷物質の種類によって溶解度は変わる
❸温度が変化すると溶解度も変化する
❷物質の種類によって溶解度は変わる
❸温度が変化すると溶解度も変化する
物質による溶解度の違い
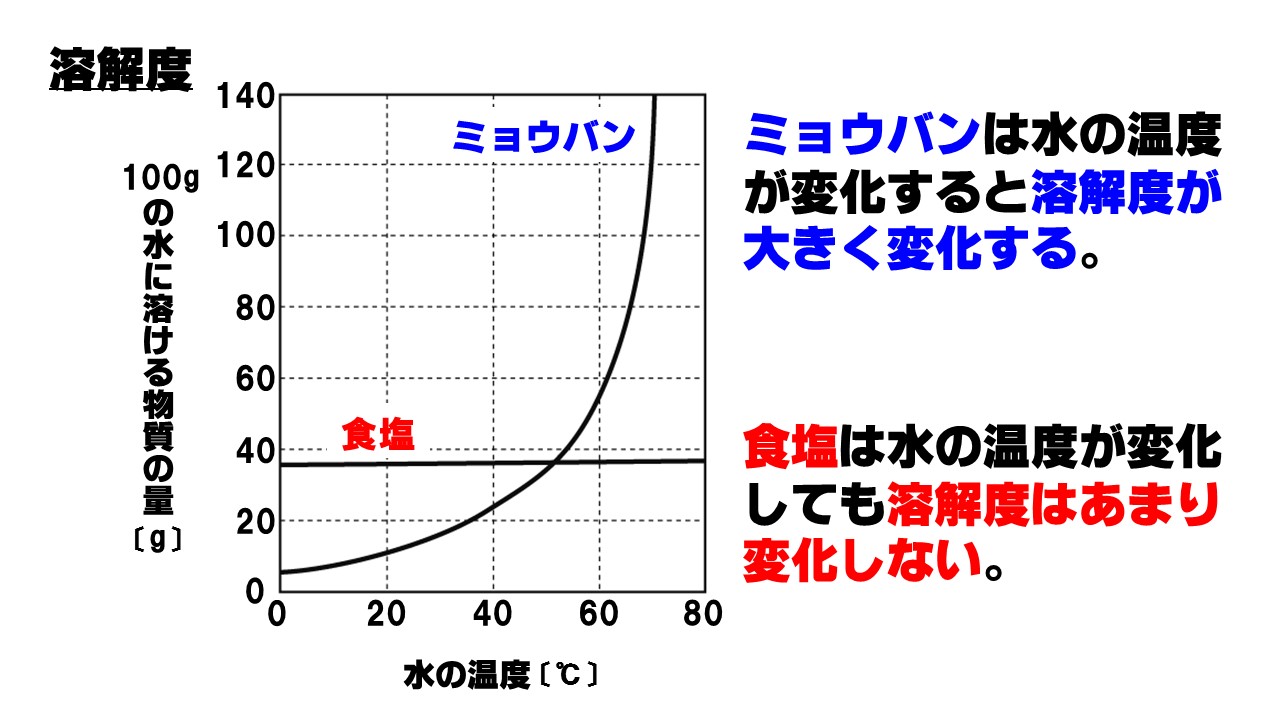
上のグラフは、水の温度が変化したときに物質が水に溶ける量がどのように変化するのかを表したグラフで、溶解度曲線といいます。
溶解度は物質の種類によって大きく異なります。ミョウバンや硝酸カリウムなどは、温度が変化すると溶解度も大きく変わりますが、食塩は温度が変化しても溶解度があまり変化しません。
再結晶とは?
再結晶とは、物質を高温の水に溶かし、水の温度を下げることで再び結晶として取り出す操作のことです。
ミョウバンのように、水の温度によって溶解度が大きく変化するような物質は再結晶によって物質をとり出すことができます。
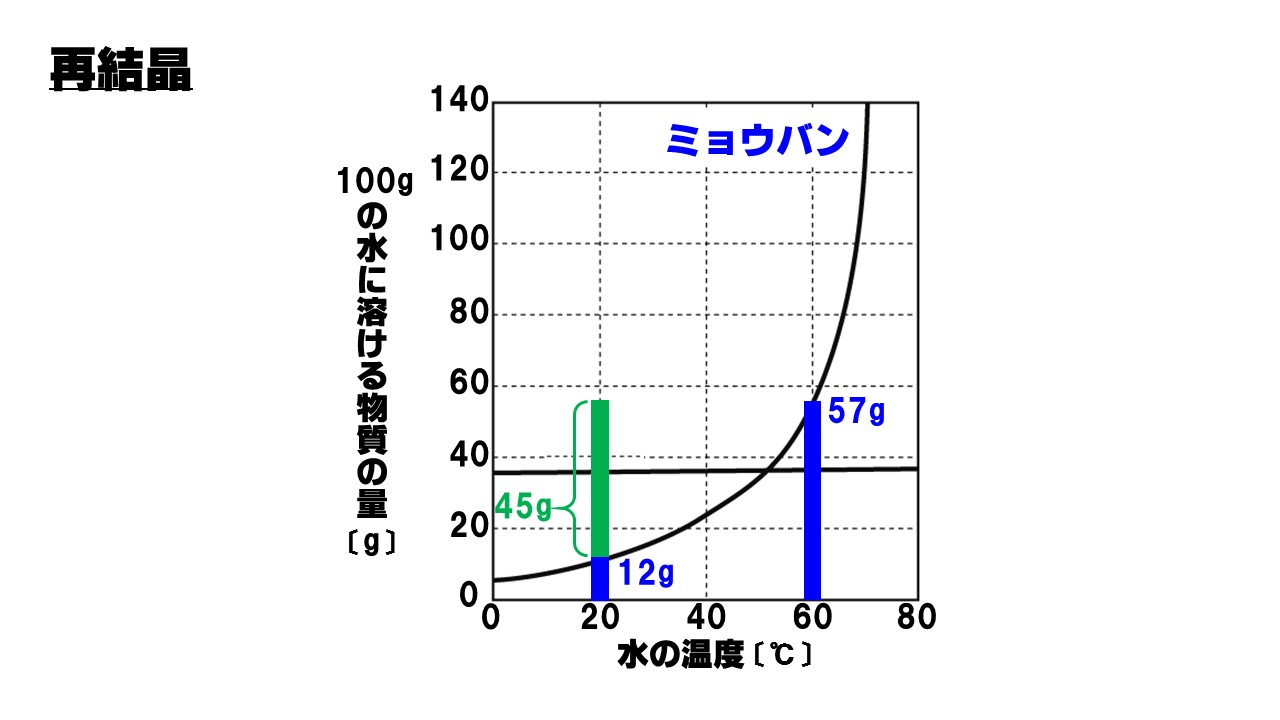 〔例題〕ミョウバンを60℃の水100gに溶けるだけ溶かし、20℃まで冷却すると何gのミョウバンの結晶が得られるか?
〔例題〕ミョウバンを60℃の水100gに溶けるだけ溶かし、20℃まで冷却すると何gのミョウバンの結晶が得られるか?
- 60℃の水100gにミョウバンは57g溶ける。
- 20℃の水100gにはミョウバンは12gしか溶けない。
- 57g-12g=45g
- 再結晶で出てくるミョウバンの量は45gである!
記述で書けるようになろう!Q:再結晶とはどのような操作か?
A:物質を高温の水に溶かし、温度を下げて再び結晶として取り出す操作のこと。
A:物質を高温の水に溶かし、温度を下げて再び結晶として取り出す操作のこと。
食塩水から結晶を取り出す方法
食塩水は、温度が変化しても溶解度があまり変化しません。したがって、水溶液の温度を下げて再結晶をしようとしても結晶が出てきません。
では、どうやって結晶を取り出せばいいのかというと、加熱して水分をすべて蒸発させるしかありません。ここは、よく定期テストや入試でも出題されます。
記述で書けるようになろう!Q:食塩水は再結晶に向いていない理由を答えよ!
A:水溶液の温度が変化しても、溶解度があまり変化しないから。
Q:食塩水から結晶を取り出すにはどのような方法があるか?
A:加熱して水分をすべて蒸発させる。
A:水溶液の温度が変化しても、溶解度があまり変化しないから。
Q:食塩水から結晶を取り出すにはどのような方法があるか?
A:加熱して水分をすべて蒸発させる。
問題を解く! 中1理科|溶解度と再結晶の計算|テスト対策問題


コメント
期末考査のテスト範囲だったので、良い勉強になりました。
ありがとうございます。
期末テストの範囲だったので良い対策になりました。
入試を控えているのでめちゃくちゃありがたいです