イオンで登場する化学電池は、定期テストや高校入試でも超頻出の単元になります。イオン化傾向を必要な分だけ覚えて、電池を完璧にマスターしましょう。また、水素と酸素を使った電池である燃料電池のつくりも解説します。
電池とは
電池(化学電池)を使ったことは誰でもありますよね。この化学電池は、仕組みさえわかれば誰でも簡単に作ることができます。まずは、化学電池の仕組みを説明します。
化学電池とは、化学変化により化学エネルギーを電気エネルギーに変換してとり出す装置です。乾電池や燃料電池なども同じように、化学変化により化学エネルギーを電気エネルギーとして取り出しています。
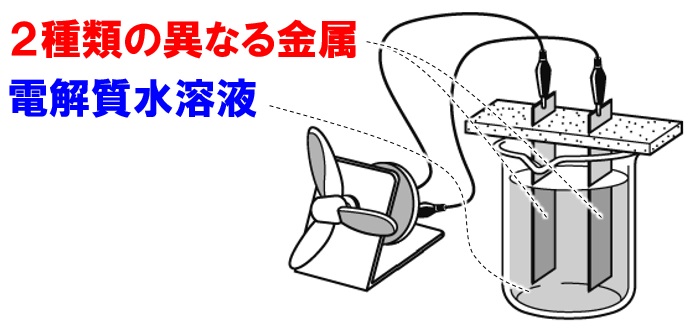
化学電池をつくるには?
化学電池をつくるには次の2つの物質が必要です。
- 2種類の異なる金属
- 電解質が溶けた水溶液
まずは、2種類の異なる金属ですが、鉄と銅、亜鉛とマグネシウムなど2種類の金属であれば電池として電流をとり出すことができます。イオン化傾向の違いを利用しているのですね。
次に、電解質が溶けた水溶液ですが、塩酸や食塩水など、水に溶かすと電流を流す物質が溶けていれば何でも構いません。電池に使用できない水溶液は、非電解質が溶けている水溶液です。非電解質は次の3つを覚えておけば大丈夫です。
- 砂糖水
- エタノール
- デンプンのり
ここまでのポイントをまとめておきます。
❷2種類の異なる金属と電解質が溶けた水溶液があれば電池になる!
❸非電解質は3つ覚える!砂糖・エタノール・デンプン!
化学電池の仕組み
2種類の異なる金属を電解質が溶けた水溶液に入れると、次のような化学変化が生じます。ここでは、亜鉛板と銅板を使ったボルタ電池というもっとも単純な電池を学習します。
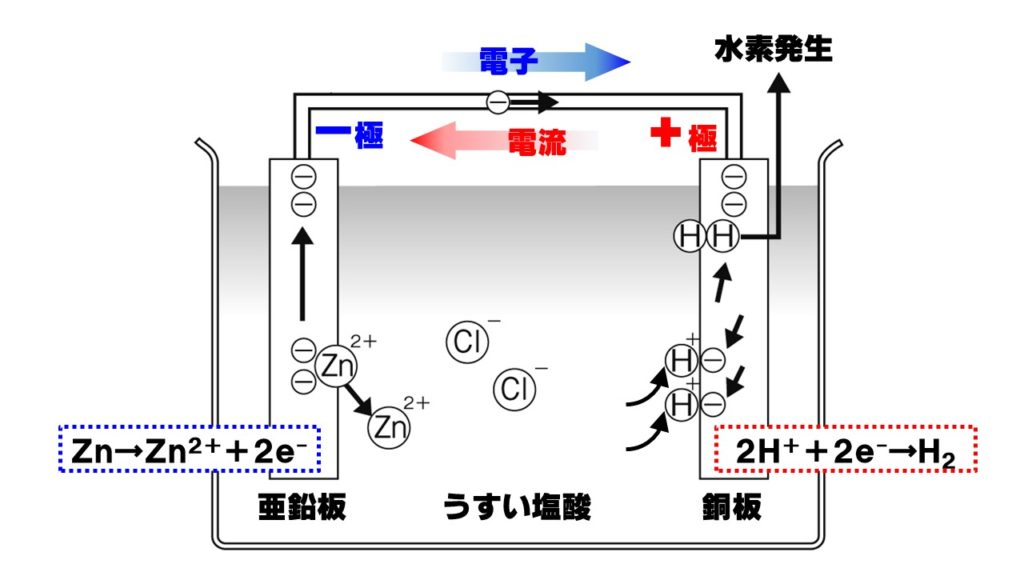
- 銅Cuよりも亜鉛Znの方がイオン化傾向が大きいので、亜鉛Znが電子2個放出し亜鉛イオンZn²⁺になりうすい塩酸中に溶ける。
Zn→Zn²⁺+2e⁻ - 電子e⁻が導線を通って、亜鉛板から銅板に移動する。
- 塩酸中の水素イオンH⁺が銅板にやってきた電子を受けとり水素原子Hに戻る。
- 水素原子Hが2個結びついて水素分子H₂になって銅板から水素が発生する。
2H⁺+2e⁻→H₂
金属板のうち、亜鉛板は水溶液に溶けるのでぼろぼろになります。一方の銅板からは水素が発生するので表面に気泡がつきます。
電子と電流
化学電池として電流をとり出しているとき、電子と電流の向きは次のようになります。
- 電子…亜鉛板から銅板
イオン化傾向が大きい金属板(亜鉛板)からイオン化傾向が小さい金属板(銅板)に電子が移動 - 電流…銅板から亜鉛板
電流は+極(銅板)から-極(亜鉛板)に向かって流れる
イオン化傾向
化学電池で電流をとり出す仕組みをもっと理解するには、イオン化傾向という金属のイオンへのなりやすさ、いいかえると金属のとけやすさを理解する必要があります。以下に紹介するイオン化傾向は、高校の化学で必要ですが高校入試レベルではすべて覚える必要はありません。参考までに紹介します。

覚え方は、「貸そうかな まああてにすんな ひどすぎる 借金」があります。イオン化傾向が大きい金属ほどイオンになりやすく、溶けやすい金属になります。
一方のイオン化傾向が小さい金属は、イオンになりにくく化学変化も起こしにくい金属です。化学変化しにくいということは酸化もしにくく、ずっと輝きを保ち続ける高価な金属でもあります。
中学校で覚えるべきイオン化傾向は次の内容になります。ここまで覚えると、高校受験の難しい問題にも対応ができます。
マグアルアエンテツドウ
化学電池ときたら「イオン化傾向」。そしてイオン化傾向の覚え方が『マグアルアエンテツドウ』です。「曲がるから会えない鉄道」→「まが~るあえんてつどう」→「マグアルアエンテツドウ」→「Mg(マグネシウム)>Al(アルミニウム)>Zn(亜鉛)>Fe(鉄)>Cu(銅)」無理やりですが、これで覚えましょう。
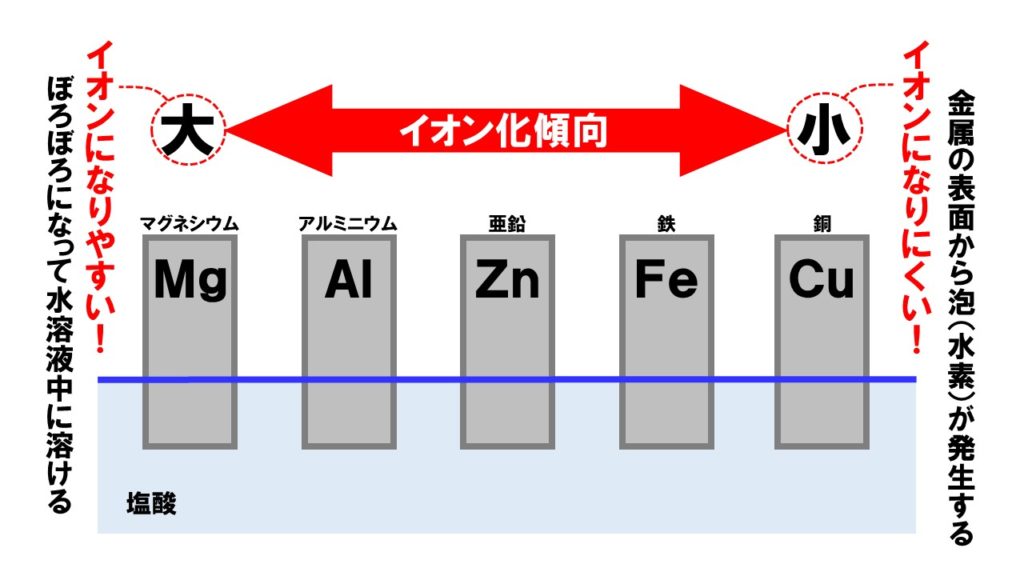
イオン化傾向が大きい金属は、イオンに成りたがろうとする金属で、水溶液中に溶けだしぼろぼろになっていく金属です。
一方のイオン化金属が小さい金属は、イオンになりたがらない金属で、化学変化を起こしません。これをふまえて、もう一度化学電池を見ていきましょう。
亜鉛と銅の化学電池
最もテストや入試に登場する金属の組み合わせが、亜鉛と銅です。このときイオン化傾向を考えると、亜鉛Znの方がイオンになりやすく、銅Cuの方がイオンになりにくいことがわかります。
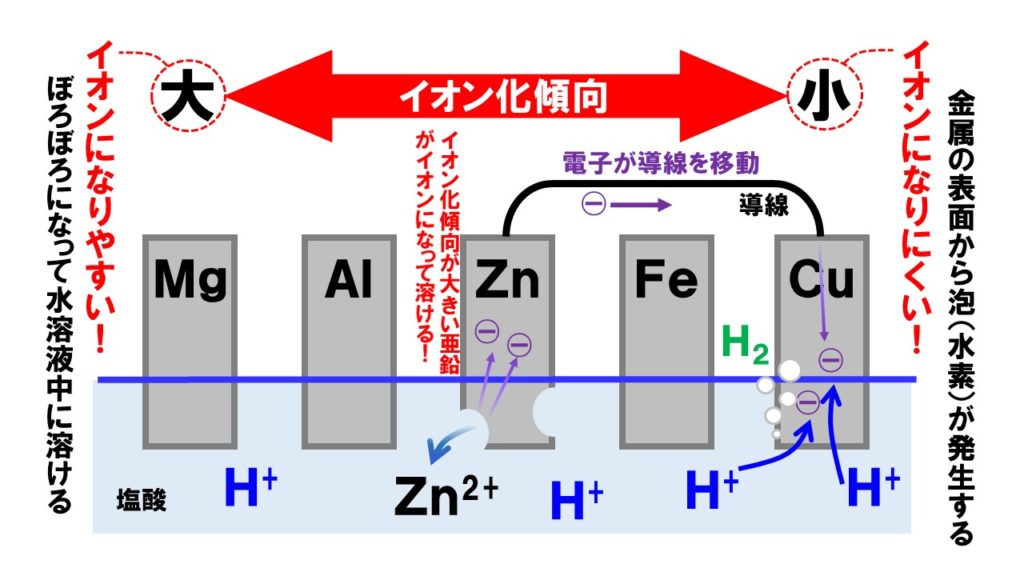
| 亜鉛 | 銅 | |
| 化学式 | Zn | Cu |
| イオン化傾向 | 大きい | 小さい |
| 表面の変化 | ぼろぼろになる | 泡(水素)発生 |
| 極 | -極 | +極 |
一次電池と二次電池
電池が電流を流す現象を放電といいます。化学エネルギーが電気エネルギーに変わります。それとは逆に電池に電流を流して、電気エネルギーを化学エネルギーに変えることを充電といいます。
一次電池
一次電池とは、放電だけできる電池で充電ができない電池です。つまり使い切りの電池になります。一次電池の例として、次の電池を覚えておきましょう。
- マンガン乾電池
- アルカリマンガン乾電池
- 酸化銀電池
二次電池
二次電池とは、充電ができる電池です。電池に電流を流すことで電圧が復活し、繰り返し使えるのです。二次電池の例として、次の電池を覚えておきましょう。
- 鉛蓄電池
- リチウムイオン電池
- ニッケル水素電池
対策問題 【定期テスト対策問題】化学電池の問題


コメント