【中学理科作図問題】イオン・電離・中和の作図問題です。
作図問題「イオン編」
イオンと化学変化の作図問題は、電離したときのイオンのようすや、中和反応と水素イオンや水酸化物イオンのようすなどが作図問題としてよく出題されます。また、グラフを使った計算問題なども出題されます。特にグラフの計算は難化しやすいので、しっかりと対策が必要です。
塩酸の電気分解
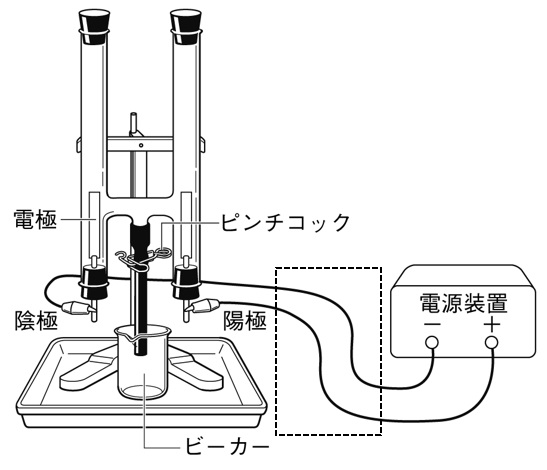
下の図は、塩酸の電気分解のようすを表したものである。電源装置から出る導線と電気分解装置を正しく接続しなさい。
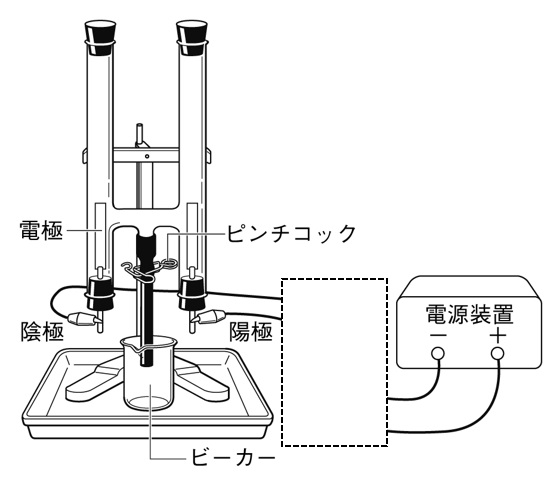
解答
電源装置の+極が接続されている電極が陽極、-極が接続されている電極が陰極になります。
原子のつくり
物質を構成する最小の粒である原子には、中心に陽子と中性子を含む原子核があり、その周りを電子があります。下の図は原子のつくりを表している。電子のようすがわかるように、下の図に⊖を書き入れなさい。
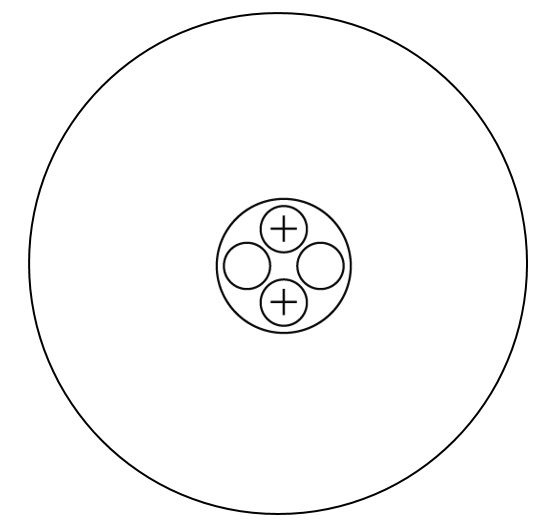
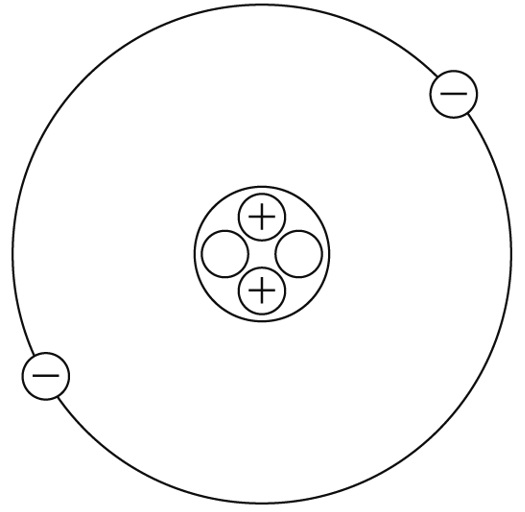
解答
原子では、必ず陽子の数と電子の数が等しくなります。陽子が原子核中に2個存在しているので、電子の数も2個となります。
塩酸の電離
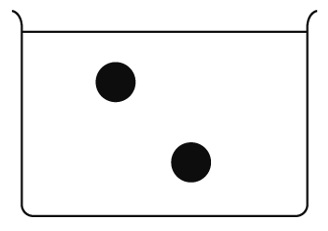 右の図は、塩化水素を水に溶かしたときの電離のようすの一部を表したものである。塩化水素を水に溶かすと、水素イオンと塩化物イオンが生じるが、水素イオンを●で表している。残りの塩化物イオンのようすを○を使って図の中に書き入れなさい。
右の図は、塩化水素を水に溶かしたときの電離のようすの一部を表したものである。塩化水素を水に溶かすと、水素イオンと塩化物イオンが生じるが、水素イオンを●で表している。残りの塩化物イオンのようすを○を使って図の中に書き入れなさい。
解答
塩化水素が水にとけるときの電離のようすは、次の式で表されます。
HCl→H⁺+Cl⁻
つまり、水素イオンと塩化物イオンは1:1で生じます。水素イオン●が2個かいてあるので、塩化物イオン○も1:1になるように2個かきます。
塩化銅の電離
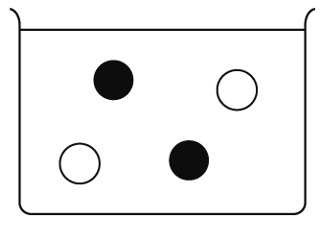
 右の図は、塩化銅を水に溶かしたときの電離のようすの一部を表したものである。塩化銅を水に溶かすと、銅イオンと塩化物イオンが生じるが、銅イオンを●で表している。残りの塩化物イオンのようすを○を使って図の中に書き入れなさい。
右の図は、塩化銅を水に溶かしたときの電離のようすの一部を表したものである。塩化銅を水に溶かすと、銅イオンと塩化物イオンが生じるが、銅イオンを●で表している。残りの塩化物イオンのようすを○を使って図の中に書き入れなさい。
解答
塩化銅が水に溶け電離するようすは、次の式で表されます。
CuCl₂→Cu²⁺+2Cl⁻
つまり、銅イオンと塩化物イオンは1:2で生じます。銅イオン●が2個かいてあるので、1:2の比になるように、塩化物イオン○は4個かきます。
化学電池と電子
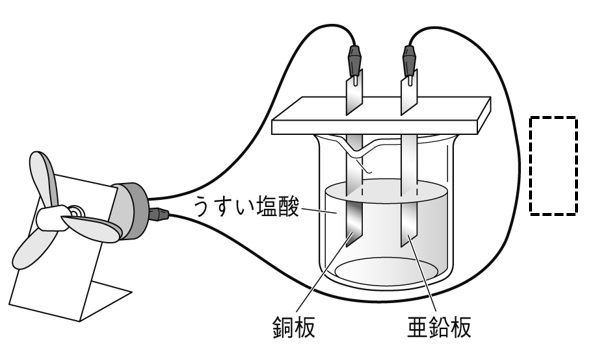
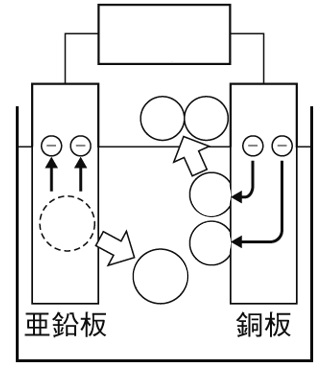
下の図は、うすい塩酸に銅板と亜鉛板を差し込んで作った化学電池を表している。この化学電池にプロペラ付きモーターを接続すると、モーターが回転し始めた。このとき、導線中を電子はどの向きに移動しているか。矢印を書き入れなさい。
解答
亜鉛と銅で電池をつくった場合、亜鉛が-極、銅が+極になり、亜鉛板から銅板に向かって電子が移動します。このとき、電流は銅板から亜鉛板に流れます。
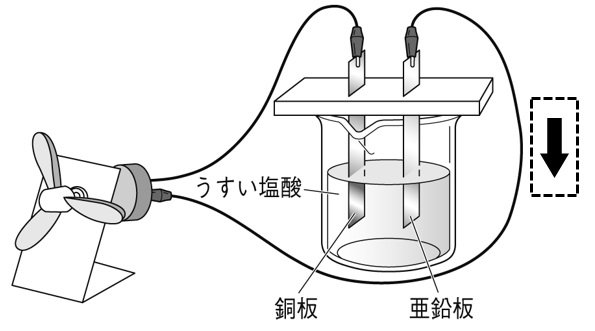
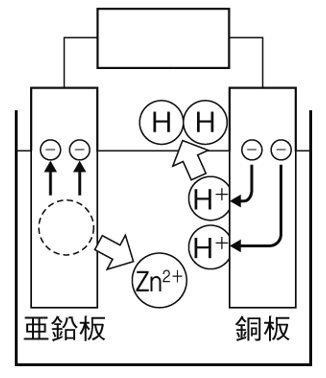
化学電池とイオン
下の図は、うすい塩酸に銅板と亜鉛板を差し込んで作った化学電池を表している。亜鉛板と銅板では、亜鉛板で電子を放出する変化が起こり、銅板では電子を受け取る変化が生じている。下の図の中に、生じるイオンや原子を、イオン式と原子の記号を書き入れて表しなさい。
解答
亜鉛が溶け亜鉛イオンになります。このとき亜鉛原子は電子を2個放出しますので、2価の陽イオンZn²⁺になります。導線を通って銅板にやってきた電子は、うすい塩酸中の水素イオンH⁺が受け取り水素原子に戻ります。できた水素原子は2個結び付き、水素分子となって発生します。
中和とイオン
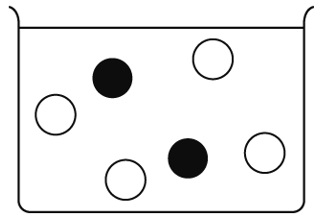
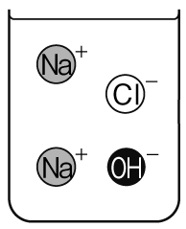
うすい塩酸と水酸化ナトリウム水溶液を混ぜる、中和の実験を行っている。下の図は、これから混ぜ合わせるうすい塩酸と水酸化ナトリウム水溶液の中の、イオンのようすを表している。この2つの水溶液を混ぜ合わせた後、水溶液中に残るイオンを作図しなさい。
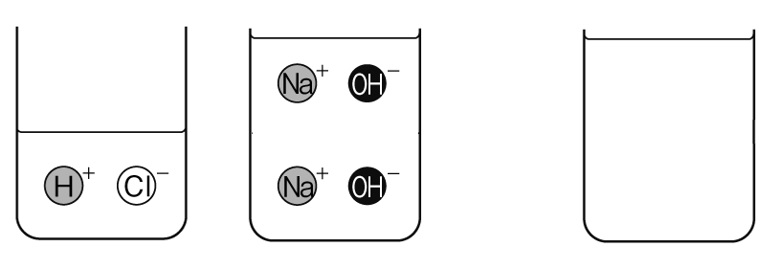
解答
うすい塩酸の中の水素イオンH⁺1個と水酸化ナトリウム水溶液中の水酸化物イオンOH⁻1個が打ち消しあい水になります。それ以外のイオンは水溶液中に残っています。
中和と気体の発生
次の実験①と②を参考に、うすい塩酸8㎤にうすい水酸化ナトリウム水溶液を入れ、その中にマグネシウムリボンを入れて発生する気体の体積を調べたときのグラフを完成させなさい。
〔実験①〕うすい塩酸40㎤にうすい水酸化ナトリウム水溶液30㎤を混ぜると、中和反応が起こりお互いの性質を完全に打ち消しあった。
〔実験②〕うすい塩酸40㎤にマグネシウムリボンを入れると、過不足なく反応し400㎤の気体が発生した。
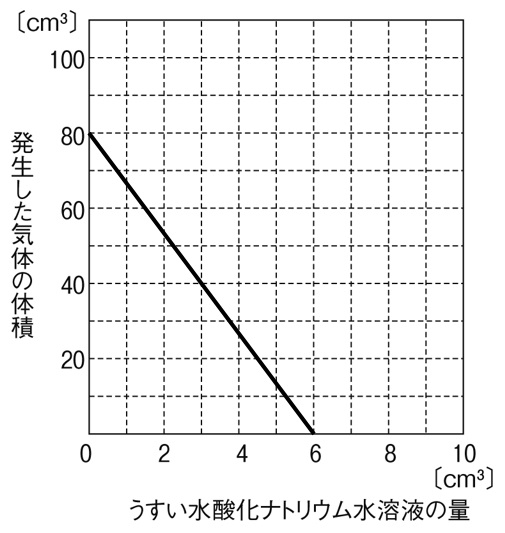
解答
実験①より、うすい塩酸とうすい水酸化ナトリウム水溶液は4:3で完全に中和することがわかります。したがって、うすい塩酸8㎤と完全に中和するうすい水酸化ナトリウム水溶液は6㎤だと計算できます。また、実験②よりうすい塩酸と発生する気体の体積の比は1:10であることがわかります。したがって、うすい塩酸8㎤から発生する気体は80㎤であるとわかります。うすい水酸化ナトリウム水溶液の量が0のときは、気体が80㎤発生し、うすい水酸化ナトリウム水溶液が6㎤入ると、うすい塩酸が完全に打ち消され、気体が発生しなくなります。
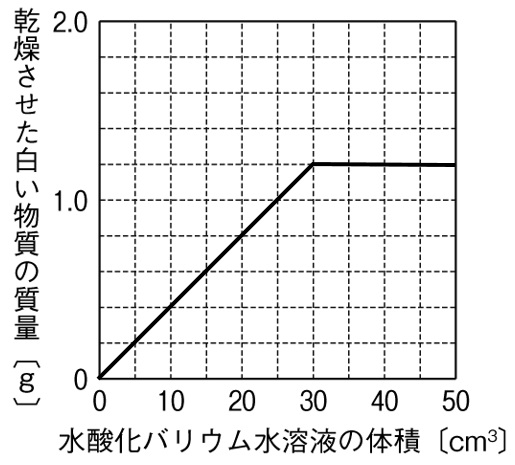
中和と沈殿の量
ビーカー内のうすい硫酸20㎤にBTB溶液を数滴加え、こまごめピペットを使ってうすい水酸化バリウム水溶液を入れる実験を行った。水酸化バリウム水溶液を30㎤加えたところでBTB溶液の色が黄色から緑色に変化した。このとき中和で生じた白い物質の質量を測定すると1.2gであった。この結果を下のグラフに書き入れなさい。ただし、乾燥させた白い物質の質量は、中和で生じた白い物質の質量のみが含まれているものとする。
解答
硫酸と水酸化バリウム水溶液の中和で生じる塩は、水に溶けにくい硫酸バリウムになります。これが白い沈殿物をつくります。硫酸20㎤と水酸化バリウム水溶液30㎤で完全に反応しているので、水酸化バリウム水溶液を30㎤加えた以降は、沈殿が生じなくなります。
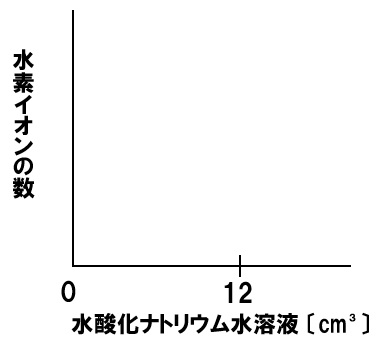
中和と水素イオンの数
一定量のうすい塩酸に水酸化ナトリウム水溶液を加える実験を行った。うすい塩酸に水酸化ナトリウム水溶液を12㎤加えると水溶液は中性になった。このときの水素イオンの数の変化を表すグラフを下のグラフに書き入れなさい。
解答
水素イオンは水酸化ナトリウム水溶液中の水酸化物イオンによって打ち消され、どんどん減少していきます。水酸化ナトリウム水溶液を12㎤加えると完全い水素イオンはなくなります。
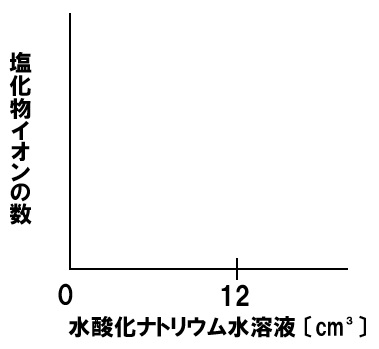
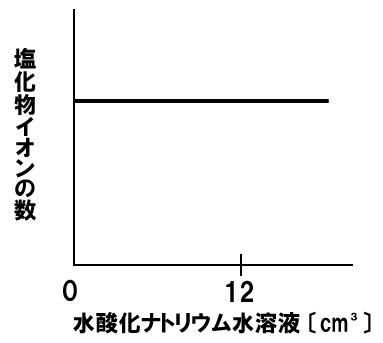
中和と塩化物イオンの数
一定量のうすい塩酸に水酸化ナトリウム水溶液を加える実験を行った。うすい塩酸に水酸化ナトリウム水溶液を12㎤加えると水溶液は中性になった。このときの塩化物イオンの数の変化を表すグラフを下のグラフに書き入れなさい。
解答
うすい塩酸中の塩化物イオンは、水酸化ナトリウム水溶液を加えても変化しません。
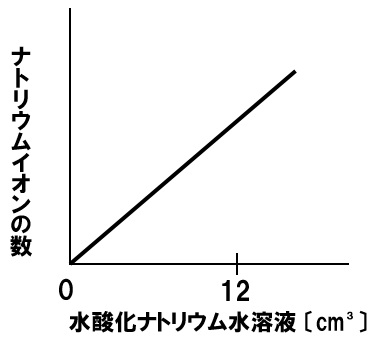
中和とナトリウムイオンの数
一定量のうすい塩酸に水酸化ナトリウム水溶液を加える実験を行った。うすい塩酸に水酸化ナトリウム水溶液を12㎤加えると水溶液は中性になった。このときのナトリウムイオンの数の変化を表すグラフを下のグラフに書き入れなさい。
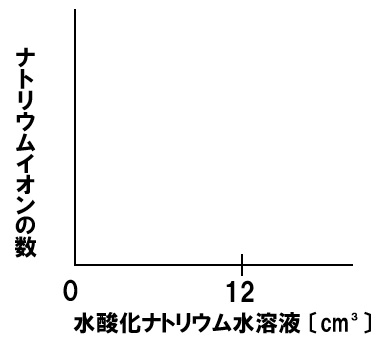
解答
水酸化ナトリウム水溶液を加えれば加えるほど、ナトリウムイオンの数は増加していきます。
中和と水酸化物イオンの数
一定量のうすい塩酸に水酸化ナトリウム水溶液を加える実験を行った。うすい塩酸に水酸化ナトリウム水溶液を12㎤加えると水溶液は中性になった。このときの水酸化物イオンの数の変化を表すグラフを下のグラフに書き入れなさい。
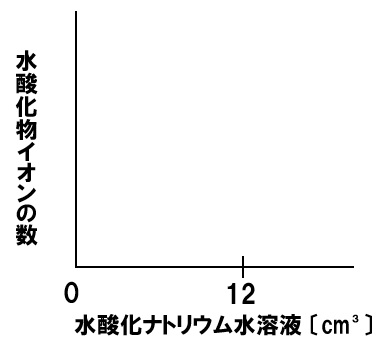
解答
水酸化ナトリウム水溶液を加えても、最初のうちは塩酸中の水素イオンと反応して水になるので、水酸化物イオンの数は増加しませんが、塩酸中の水素イオンがなくなると、水酸化ナトリウム水溶液を加えた分だけ水酸化物イオンの数は増加していきます。
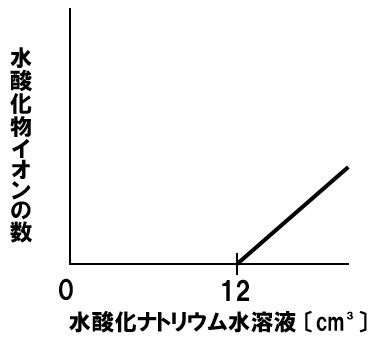
中和とイオン総数
一定量のうすい塩酸に水酸化ナトリウム水溶液を加える実験を行った。うすい塩酸に水酸化ナトリウム水溶液を12㎤加えると水溶液は中性になった。このときの水溶液中に存在するすべてのイオンの数の変化を表すグラフを下のグラフに書き入れなさい。
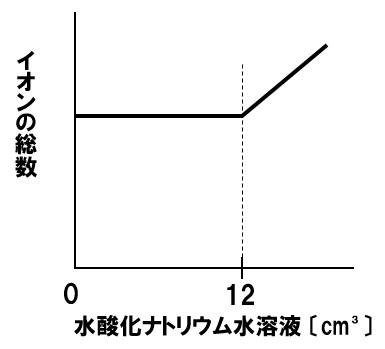
解答
完全に打ち消しあうまでは、水素イオンと水酸化物イオンが打ち消しあい水になるので、イオン総数は変化しませんが、完全に中和した後は、加えた水酸化ナトリウム水溶液にあるナトリウムイオンと水酸化物イオンが増加していくので、イオン総数も増加していきます。


コメント