水の電気分解について詳しく見ていきましょう。ここは中学2年生のときに、電気分解の単元で学習済みですが、さらに詳しく学習することになります。一部発展内容が入っているので、必要な生徒のみ学習してください。
水の電気分解
まずは、中学2年生のときに学習した内容の復習です。
水酸化ナトリウムを溶かした水を簡易電気分解装置に入れ電流を流すと、陽極から酸素O₂、陰極から水素H₂が発生します。このように電流を流し、物質を分解する操作を電気分解といいます。
- 水 → 水素 + 酸素
2H₂O→2H₂+O₂
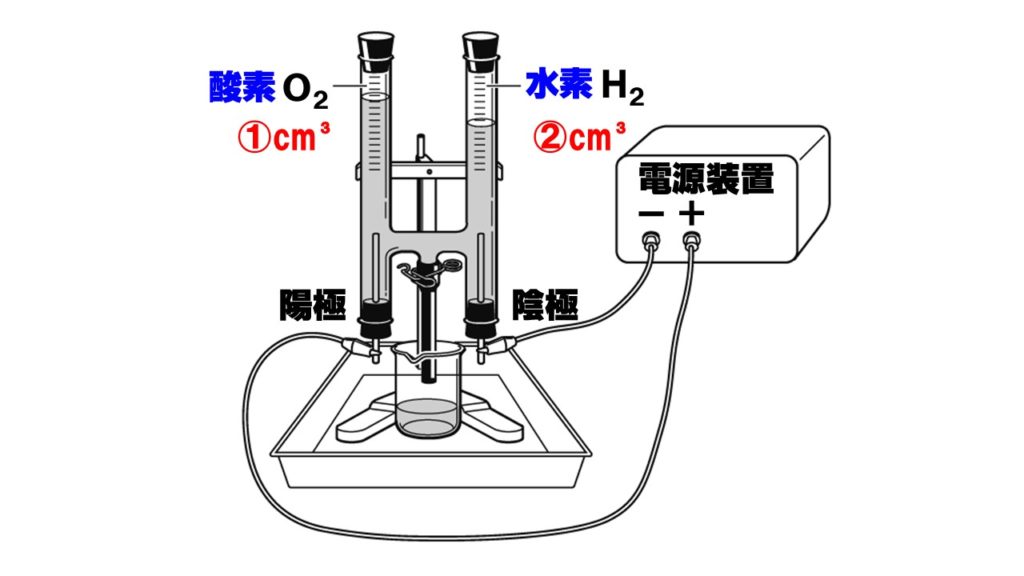
このとき、発生する気体の体積の比は、水素:酸素=2:1になります。発生した気体の調べ方は次の通りです。
- 水素…マッチの火を近づけると爆発して水ができる。
- 酸素…線香の火を近づけると炎をあげて激しく燃える。
水酸化ナトリウムをとかす理由
水の電気分解をする前に、水に水酸化ナトリウムをとかす理由は、純粋な水には電流が流れないからです。水に水酸化ナトリウムをとかすことで、電流が流れやすくなるのです。
なぜ、水酸化ナトリウムを水に溶かすのか聞かれた場合は、次のうちどれかを答えるといいでしょう。
- 「純粋な水には電流が流れないから。」
- 「水に電流を流れやすくするため。」
- 「小さな電圧で電気分解を進めるため。」
ここまでは、学習済みですが、ここから中学3年生で学習する発展内容になります。必要な生徒のみ学習してください。
水の電気分解をもっと詳しく
水の電気分解を行っているとき、水溶液中のイオンや分子はどのように移動しているのでしょうか。水を電気分解するために、水酸化ナトリウム水溶液を水に溶かしました。したがって、水酸化ナトリウムNaOHが電離して、次のようなイオンがあります。
- 水酸化ナトリウム→ナトリウムイオン+水酸化物イオン
NaOH→Na⁺+OH⁻
陽極での変化
水酸化ナトリウムを溶かした水を電気分解しているとき、陽極では次のような反応が起こっています。
4OH→O₂+2H₂O+4e⁻
水溶液中にあるイオンはNa⁺とOH⁻です。陽極に引き寄せられるのは、マイナスの電気を帯びた水酸化物イオンOH⁻になります。
陽極に引き寄せられた水酸化物イオンOH⁻は陽極に電子e⁻を渡し、酸素と水が発生します。電子は導線を通って陰極の方に移動します。
陰極での変化
水酸化ナトリウムを溶かし水を電気分解しているとき、陰極では次のような反応が起こっています。
4H₂O+4e⁻→2H₂+4OH⁻
導線を通って移動してきた電子が陰極にたまります。水溶液中にあるナトリウムイオンNa⁺はイオン化傾向が大きく、非常に電子を受けとりにくいイオンです。なので、水H₂Oが陰極から電子を受けとって水素が発生します。
水の電気分解の化学反応式
上記の2つの式を足し合わせてみると、
(4OH⁻→O₂+2H₂O+4e⁻) + (4H₂O+4e⁻→2H₂+4OH⁻)
2H₂O→2H₂+O₂
となります。


コメント