溶解度曲線を読み取り、物質が水に溶ける量を計算する問題演習です。再結晶量の計算や、濃度の計算も練習しましょう。
ポイント 【中1理科】溶解度と再結晶のポイント
【練習問題1】溶解度・再結晶
下のグラフは、100gの水に溶けるミョウバンと食塩の量を表したものである。これについて、後の各問いに答えよ。
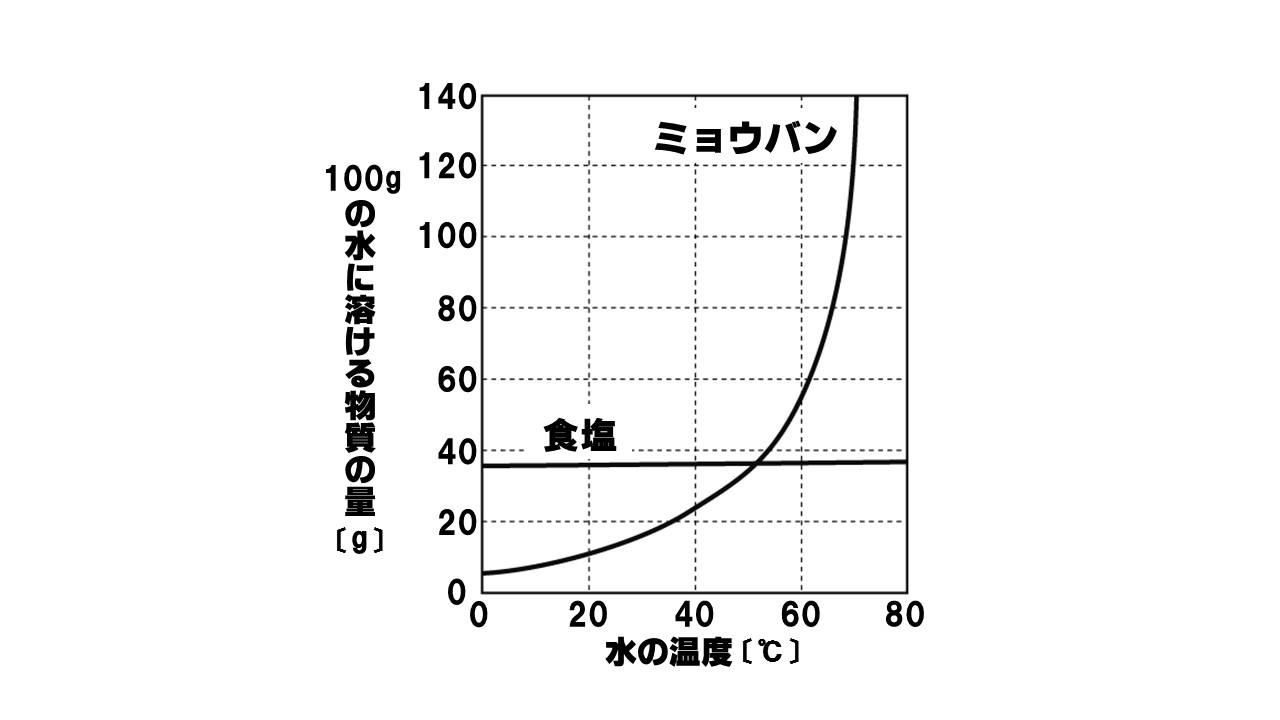
- 60℃の水200gにミョウバンは何g溶けるか。
- 40℃の水50gに食塩は何g溶けるか。
- 40℃の水100gにミョウバンを溶けるだけ溶かしたときの水溶液の濃度は何%か。
- 80℃の水100gにミョウバンを120g溶かし、水溶液の温度を60℃まで下げると何gの結晶が得られるか。
- 80℃の水200gにミョウバンを100g溶かし、水溶液の温度を20℃まで下げると何gの結晶が得られるか。
【解答・解説1】溶解度・再結晶
- 114g
60℃の水100gにミョウバンは57g溶けるので、2倍の200gの水には、57×2=114g溶ける。 - 18g
40℃の水100gに食塩は36g溶けるので、100gの半分の50gの水には、36÷2=18g溶ける。 - 20%
40℃の水100gにミョウバンは25g溶ける。このときの水溶液の質量は、100g+25g=125gとなる。したがって濃度は25÷125×100=20%となる。 - 63g
60℃の水100gにミョウバンは57g溶けるので、120g-57g=63gの結晶が出てくる。 - 78g
20℃の水100gにミョウバンは11g溶けるので、水200gには22g溶ける。したがって出てくる結晶の量は100g-22g=78gとなる。
【練習問題2】溶解度曲線
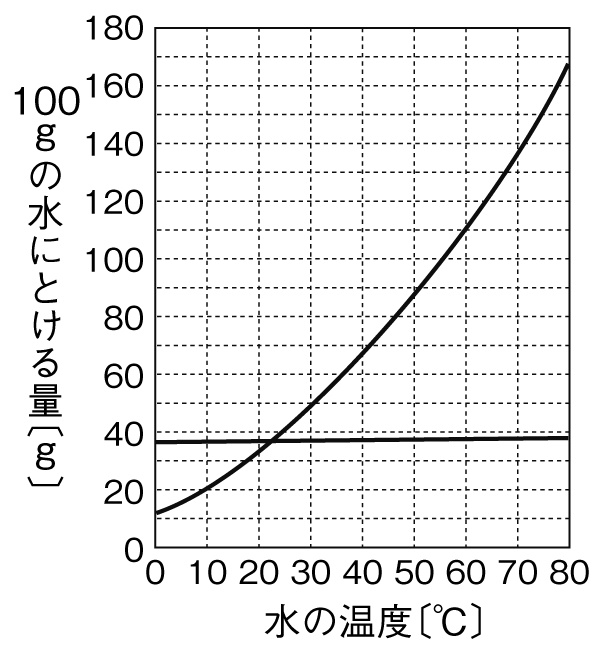 [問題]右のグラフは、硝酸カリウムと塩化ナトリウムの溶解度曲線を表している。これについて、次の各問いに答えなさい。
[問題]右のグラフは、硝酸カリウムと塩化ナトリウムの溶解度曲線を表している。これについて、次の各問いに答えなさい。
(1)60℃の水100gに硝酸カリウム80gを溶かして、硝酸カリウム水溶液をつくった。この水溶液を冷やしていくと、およそ何℃で結晶が出始めるか。
(2)(1)水溶液を10℃まで冷却すると、約何gの結晶が出てくるか。
(3)次に、60℃の水200gに硝酸カリウム130gを溶かして、硝酸カリウム水溶液をつくった。この水溶液の濃度は何%か。小数第一位を四捨五入し、整数で求めよ。
(4)(3)の水溶液が冷えて、硝酸カリウムが結晶になりはじめる温度は約何℃か。
(5)(3)の水溶液を0℃まで冷却すると、約何gの硝酸カリウムの結晶が出てくるか。
(6)60℃の水100gに塩化ナトリウムを溶けるだけ溶かし、60℃の飽和水溶液をつくった。その後、この飽和水溶液を20℃まで冷却したが、塩化ナトリウムの結晶ができるようすはほとんど観察できなかった。その理由を「溶解度」「温度」の2つのことばを用いて、簡潔に説明せよ。
【解答・解説2】溶解度曲線
(1)約46℃
硝酸カリウム80gが溶解度になるのは、水の温度が約46℃になった時です。したがって、水の温度が46℃以下になると結晶ができ始めます。
(2)60g
10℃の硝酸カリウム水溶液の溶解度は約20gなので、溶けていた80gの硝酸カリウムのうち、
80g-20g=60g
約60gの結晶が出てきます。
(3)39%
まず、硝酸カリウム130gが、60℃の水200gにすべて溶けるかを確認します。60℃の水100gの硝酸カリウムの溶解度は、グラフより約110gであるとわかります。水の量はその2倍なので、約220gまで溶けることがわかります。したがって、硝酸カリウム130gはすべて溶けます。
質量パーセント濃度は、溶質/溶液 ×100 で求めることができるので、
130/(200+130) ×100=39.393…
小数第一位を四捨五入し、整数で求めると、約39%になります。
(4)約38℃
水100gのグラフ(溶解度のグラフ)なので、まず、水100gだったら何℃で結晶が出てくるか考えます。水200gに硝酸カリウム130gを溶かしたので、その半分の水100gに硝酸カリウム65gを溶かしたことと同じになります。これを冷却すると、約38℃で結晶が出てくるとわかります。
(5)約106g
水100gのグラフ(溶解度のグラフ)なので、まず、水100gだったら何gの結晶が出てくるか計算します。水200gに硝酸カリウム130gを溶かしたので、その半分の水100gに硝酸カリウム65gを溶かしたことと同じになります。これを0℃まで冷却すると、約12gしか硝酸カリウムが溶けないことがわかります。したがって、出てくる結晶の量は、
65g-12g=約53g
実際の水の量は、100gの2倍の200gなので、出てくる結晶の量も2倍になります。
53g×2=約106g
(6)塩化ナトリウムは水の温度が下がっても、溶解度があまり変化しないから。
塩化ナトリウム(食塩)は、水の温度が変化しても、溶解度があまり変化しない物質です。したがって、温度が下がっても結晶があまり出てきません。塩化ナトリウム水溶液から結晶をとり出すには、加熱し水を蒸発させる必要があります。



コメント