化学変化とイオンで登場する、塩化銅水溶液の電気分解について学習します。電離のようすから、各電極で発生する物質まで、しっかりと内容をおさえましょう。
塩化銅水溶液の電気分解
塩化銅水溶液の電気分解も、塩酸の電気分解とほとんど仕組みは同じになります。次の内容を順序だてて覚えていきましょう。
- 塩化銅水溶液は青色の水溶液である。
- 塩化銅の電離のようすを理解する。
- 陽極と陰極での電気分解を理解する。
- 発生した物質の性質を理解する。
まず、第1段階として塩化銅水溶液は、固体の塩化銅が水に溶けていることを理解しておきましょう。さらに、塩化銅水溶液は青色の水溶液であることも重要です。これは、後で説明する銅イオンCu²⁺の色が青色だからです。
塩化銅の電離
塩化銅水溶液は、固体の塩化銅を水に溶かしたもので塩化銅水溶液の色は青色です。まずは、このときの電離のようすを見ていきましょう。
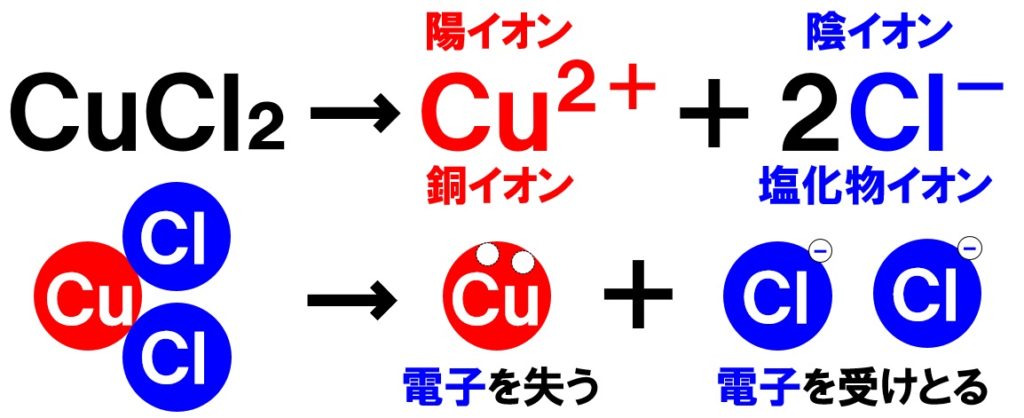
塩化銅CuCl₂が水に溶けると、銅原子Cuは電子を2つ失って銅イオンCu²⁺となります。一方の塩素原子Clの2個は、それぞれ電子1個ずつを受け取り、塩化物イオンCl⁻が2個生じます。
つまり、塩化銅水溶液の中には、銅イオンCu²⁺と塩化物イオンCl⁻が1:2の割合で存在している状態になります。銅イオンCu²⁺が水溶液中にあると、水溶液の色は青色になります。
❷CuCl₂が電離して、Cu²⁺とCl⁻が1:2の割合で存在!
塩化銅水溶液の電気分解
この塩化銅水溶液に電極を差し込み、電流を流すとどうなるでしょうか。塩化銅水溶液中には、陽イオンである銅イオンCu²⁺と、陰イオンである塩化物イオンCl⁻があるので、それぞれ次のような動きをします。
- 銅イオンCu²⁺→陰極に引き寄せられる。
- 塩化物イオンCl–→陽極に引き寄せられる。
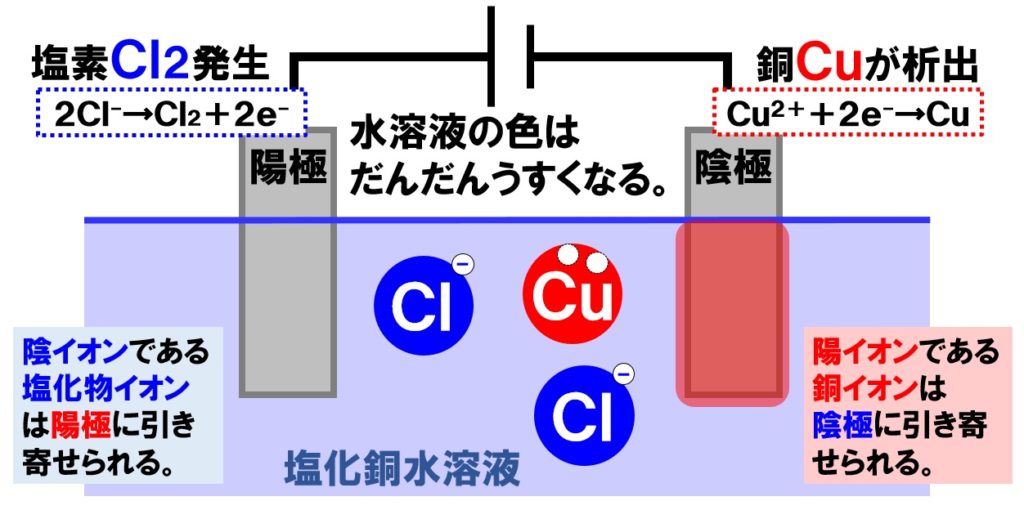
陽イオンと陰極、陰イオンと陽極で引き合う形となります。それぞれの極に移動したイオンは次のような電子のやり取りを行います。
- 陰極…銅イオンCu²⁺が電極から電子を2つ受けとり銅原子Cuになる。
- 陽極…塩化物イオンCl⁻が電子を1つ電極に渡し塩素原子Clに戻る。
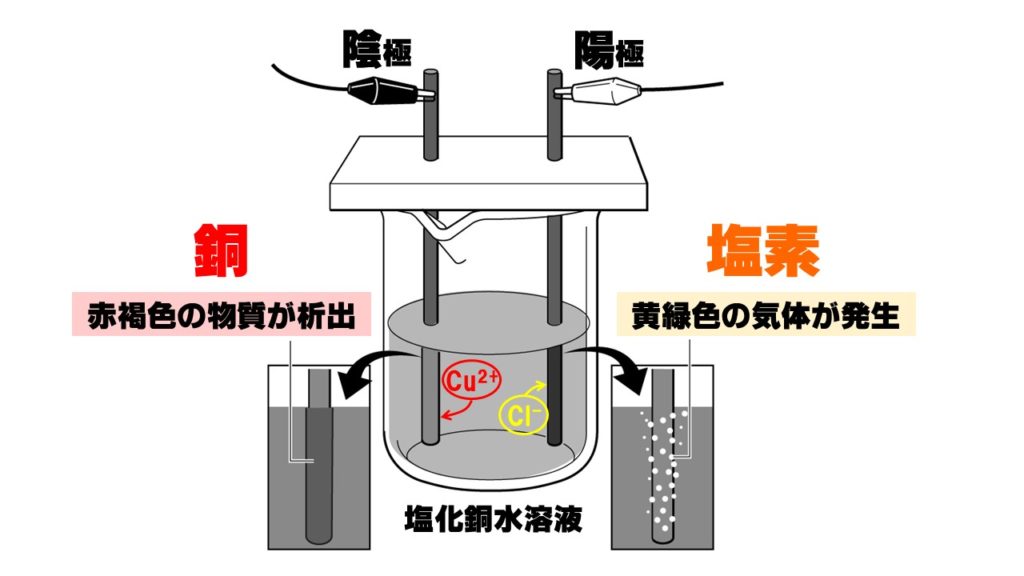
その結果、陰極には銅が析出し、陽極からは塩素が発生するのです。このとき、塩素原子Clは2個くっついて塩素分子Cl₂になって発生します。
以上をまとめると、下の図のようになります。
・陰極には銅が析出!
陰極に析出した(こびりついた)銅Cuは、赤褐色(赤色)をしています。金属ですので、金属の性質があります。
- 磨くと金属光沢が出る。
- 展性・延性がある。
- 熱や電気をよく通す。
陽極に発生する塩素Cl₂には、次のような特徴があります。
- 黄緑色で刺激臭(プールのにおい)。
- 赤インクを染み込ませたろ紙を近づけると、色が抜けて白くなる(脱色)。
塩化銅水溶液の電気分解の化学反応式
- 塩化銅→銅+塩素
- CuCl₂→Cu+Cl₂
化学反応式を聞いているのか、塩化銅の電離のようすを表す式を聞いているのかをしっかりと見てください。
❷化学反応式:CuCl₂→Cu+Cl₂
【問題】塩化銅水溶液の電気分解の問題
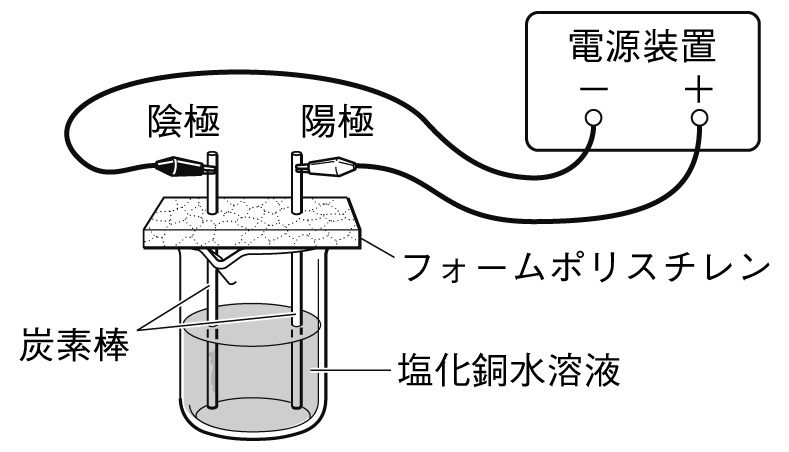 右図のように、フォームポリスチレンに炭素棒を差し込み、電源装置の+極とー極につなげ、ビーカー内の塩化銅水溶液を電気分解した。これについて、次の各問いに答えなさい。
右図のように、フォームポリスチレンに炭素棒を差し込み、電源装置の+極とー極につなげ、ビーカー内の塩化銅水溶液を電気分解した。これについて、次の各問いに答えなさい。
(1)塩化銅を水に溶かし、塩化銅水溶液をつくるとき、塩化銅は水の中でどのように電離するか。電離のようすを化学式とイオン式を使って表せ。
(2)塩化銅水溶液に電流を流したところ、陰極には赤褐色の物質が付着してきた。また、陽極からは細かな泡が発生していた。陰極と陽極に発生した物質は何か。物質名をそれぞれ答えなさい。
(3)陽極から発生した気体を調べる方法とその結果を、簡潔に書きなさい。
(4)塩化銅水溶液の色は何色か。また、電気分解を進めていくと、水溶液の色はどうなるか、簡潔に答えなさい。
(5)次の文は、塩化銅水溶液の電気分解についてまとめたものである。文中の( )に適する語句を入れなさい。
(6)塩化銅水溶液の電気分解のようすを化学反応式で書け。
【解答・解説】塩化銅水溶液の電気分解の解答
(1)CuCl₂→Cu²⁺+2Cl⁻
塩化銅の化学式はCuCl₂です。塩化銅は電解質なので、水に溶かすと電離し、銅イオンCu²⁺1個と塩化物イオンCl⁻2個に電離します。

(2)陰極:銅 陽極:塩素
塩化銅水溶液中の陽イオンである銅イオンCu²⁺が陰極に引き寄せられ、電子を2個受け取って銅原子Cuに戻り、陰極に付着します。一方の陰イオンである塩化物イオンCl⁻は陽極に引き寄せられ、電子を1個失って塩素原子Clになり、塩素原子が2個結びついて塩素分子Cl₂となって発生します。
・陽極から塩素が発生!
・陰極には銅が析出!
(3)赤インクをしみ込ませたろ紙を近づけると、色が抜けて白くなる。
陽極から発生する気体は塩素Cl2です。塩素には脱色作用があるので、インクをしみ込ませたろ紙を白くするはたらきがあります。
❶黄緑色の気体で刺激臭(プールのにおい)!
❷水に溶けやすく、水に溶けると酸性を示す!
❸空気より密度が大きいので下方置換法で集める!
❹有毒なので換気を十分に行う!
❺赤インクを染み込ませたろ紙を近づけると色が抜けて白くなる(脱色作用)!
(4)塩化銅水溶液の色:青 色の変化:うすくなっていく。
塩化銅水溶液の中には、銅イオンCu²⁺が存在します。銅イオンは青色を示します。また、電気文化を進めていくと、銅イオンが銅原子に変化していくので青色はうすくなっていきます。
❶青色がうすくなる→水溶液中のCu²⁺が減少するから
❷電流が流れにくくなる→水溶液中のイオン(Cu²⁺とCl⁻)が減少するから
(5)①塩化物 ②失い ③銅 ④受けとって
塩化銅水溶液中の陽イオンである銅イオンCu²⁺が陰極に引き寄せられ、電子を2個受け取って銅原子に戻り、陰極に付着します。一方の陰イオンである塩化物イオンCl⁻は陽極に引き寄せられ、電子を1個失って塩素原子になり、塩素原子が2個結びついて気体となって発生します。
(6)CuCl₂→Cu+Cl₂
塩化銅水溶液に電流を流すと、銅と塩素に電気分解されます。塩化銅の化学式がCuCl2であることに注意しましょう。


コメント