中学1年理科。今日のテーマは水溶液です。まずは水溶液とは何なのかから押さえ、いろいろな水溶液に溶けている物質も覚えていきましょう。
水溶液とは
水溶液とは水に物質が溶けたもので、身近な例でいうと食塩水や砂糖水などが水溶液になります。水溶液と呼べるためには次の3つの性質を満たさなくてはなりません。
水溶液の性質❶色がついていても透明
❷濃さは均一
❸放置しておいても沈殿しない
❷濃さは均一
❸放置しておいても沈殿しない
この3つの性質を満たさないと水溶液とは呼べませんので、牛乳や泥水などは水溶液とは呼べません。
溶質・溶媒・溶液
水溶液をつくるには、水に何かを溶かさなければなりません。このとき、溶かす物質、物質を溶かす液体、物質が溶けている液体に名前がありますので覚えましょう。
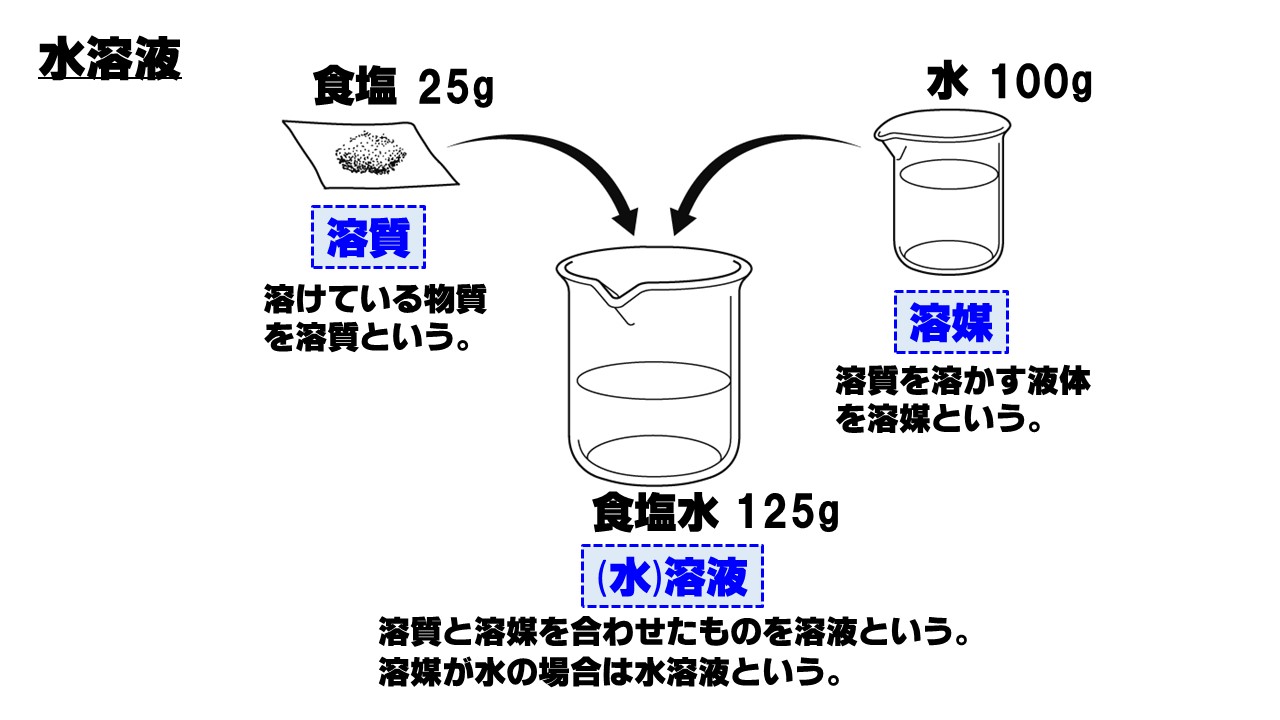
- 溶質
溶けている物質のこと - 溶媒
溶質を溶かす液体のこと - 溶液(水溶液)
溶質と溶媒を合わせたもの
溶媒が水の場合の溶液を、特に水溶液といいます。
水溶液の質量
水溶液の質量は、溶かす溶質の質量と溶媒の質量を合わせたものになります。
水溶液の質量=溶質の質量+溶媒の質量
例えば、質量25gの食塩を水100gに溶かすと、できた水溶液である食塩水の質量は、
25g+100g=125g
となります。
いろいろな水溶液
水溶液でも、次の水溶液は入試や定期テストに頻繁に登場します。溶けている物質が固体なのか気体なのか。また、何という物質が溶質なのかをしっかりと覚えましょう。
食塩水(塩化ナトリウム水溶液)
- 溶質:食塩(塩化ナトリウム)[固体]
- 臭い:無し
- 加熱すると:白い粒が残る
- 性質:中性
砂糖水
- 溶質:砂糖[固体]
- 臭い:無し
- 加熱すると:茶色のネバネバとしたものが残る
- 性質:中性
塩酸
- 溶質:塩化水素[気体]
- 臭い:刺激臭
- 加熱すると:何も残らない
- 性質:酸性
炭酸水
- 溶質:二酸化炭素[気体]
- 臭い:無し
- 加熱すると:何も残らない
- 性質:酸性
水酸化ナトリウム水溶液
- 溶質:水酸化ナトリウム[固体]
- 臭い:無し
- 加熱すると:白い粒が残る
- 性質:アルカリ性
アンモニア水(水酸化アンモニウム水溶液)
- 溶質:アンモニア[気体]
- 臭い:刺激臭
- 加熱すると:何も残らない
- 性質:アルカリ性
石灰水(水酸化カルシウム水溶液)
- 溶質:石灰(水酸化カルシウム)[固体]
- 臭い:無し
- 加熱すると:白い粒が出てくる
- 性質:アルカリ性
それでは、水溶液に関する問題に挑戦しましょう。


コメント