中1理科で学ぶ質量パーセント濃度は、計算問題が中心となるため、苦手意識を持つ人が多い単元です。
「公式は覚えたけど、どの数値を使えばいいのか分からない」
「文章題になると混乱する」
と感じていませんか?
この記事では、質量パーセント濃度の求め方を基礎から順を追って、
・公式の意味と使い方
・計算の考え方と手順
・よくある間違いと注意点
を中1にも分かる言葉で丁寧に解説します。
考え方が分かれば、計算は自然に解けるようになります。
定期テスト前の確認や、苦手克服にぜひ活用してください。
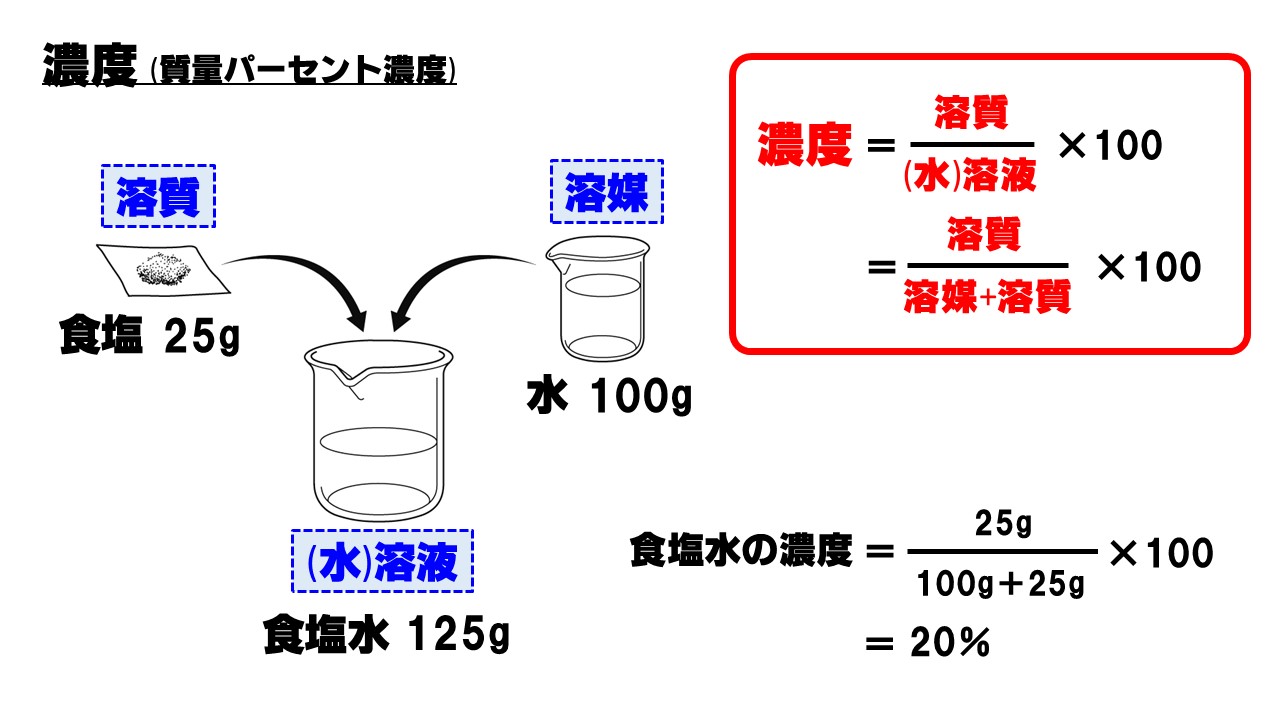
【ポイント】濃度(質量パーセント濃度)
濃度、正式には質量パーセント濃度といいます。濃度とは簡単に言うと「濃さ」のことです。どれくらいたくさんの物質が溶けているかを表す数値になります。理科的な用語で説明すると、「溶液」に対する「溶質」の割合になります。
濃度の計算方法
濃度の計算方法は、次の手順で行います。
- 溶媒と溶質を合わせた溶液の質量を求める
まずは、溶液全体の重さを求めます。 - 溶質÷溶液で溶質の占める割合を計算する
分数式で表すと分子が溶質、分母が溶液の質量です。 - 最後に100倍にして百分率(%)を求める
よくある濃度計算の間違い
濃度の計算でよくある間違いは、分母を「溶媒」で計算してしまうことです。
[悪い例]水100gに食塩25gを混ぜたときの濃度を計算せよ。
25÷100×100=25%×
[正しい例]水100gに食塩25gを混ぜたときの濃度を計算せよ。
25÷(100+25)×100=20%〇
分母は溶液の量、つまり全体の質量になります。間違えないように注意してください。
濃度の計算、質量パーセント濃度の計算を学習します。


コメント