【中2理科】酸化銀の熱分解のポイントです。
酸化銀の熱分解
酸化銀は、銀と酸素が化合した物質です。酸化銀の色は黒色で、理科の実験でよく登場します。酸化銀を加熱することで、次のような化学変化が生じます。
酸化銀(黒色)→銀(白色)+酸素
この化学変化は、1種類の物質が2種類以上の別の物質に変化しているので「分解」とよばれる化学変化になります。その中でも加熱によって分解しているので「熱分解」となります。
また、加熱前の酸化銀は黒色でしたが、加熱後に試験管内に残る銀の色は白色になります。
酸化銀と銀の性質の違い
加熱前の酸化銀と、加熱後に試験管に残る銀は、まったく別の物質になっています。次のような性質の違いが現れます。
| 加熱前 | 加熱後 | |
| 物質名 | 酸化銀 | 銀 |
| 色 | 黒色 | 白色 |
| 電流 | 流れない | 流れる |
| みがく | ぼろぼろ | 金属光沢 |
加熱前の酸化銀は金属の性質がありませんが、加熱後の銀には金属の性質が現れます。
発生した気体の調べ方
酸化銀を加熱したときに発生する気体は酸素です。したがって次のように調べます。
火のついた線香を近づける。→線香が炎をあげて激しく燃える。
気体の調べ方は非常に重要です。酸素だけでなく、水素や二酸化炭素、塩素などの調べ方も復習しておきましょう。
酸化銀の熱分解の実験の注意点
酸化銀の熱分解の実験で注意する点は、以下の点です。
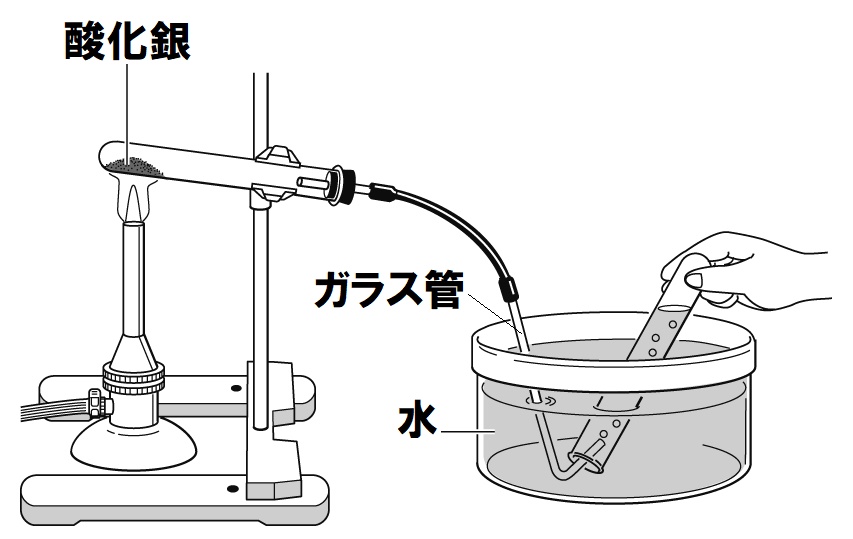
- 火を消す前に、ガラス管を水槽の水の中から取り出しておく。
→理由:水槽の水が逆流し、試験管が割れるのを防ぐため。
酸化銀の熱分解の化学反応式
まずは、登場する物質の化学式を覚えましょう。
- 酸化銀…Ag₂O
- 銀…Ag
- 酸素…O₂
酸化銀Ag₂Oの化学式を覚えていない生徒が多いので、しっかりと覚えるようにしましょう。なぜ銀原子Agと酸素原子Oが2:1の割合で化合しているのかは、高校生で化学を勉強しないとわかりません。ここは、割り切って暗記するようにしましょう。
次に化学反応式をつくります。まずは、化学変化を日本語で書き、それぞれの物質を化学式で表すところから始めます。
- 酸化銀→銀+酸素
Ag₂O→Ag+O₂
次は、化学変化の前後(矢印の左右)で、原子の数が等しくなるように係数を付けます。まずは、酸素原子Oの数を合わせ、その後に銀原子Agの数を合わせます。
- 2Ag₂O→4Ag+O₂
入試でもよく登場する化学反応式になりますので、必ず作れるようになりましょう
対策問題 【定期テスト対策問題】酸化銀の熱分解


コメント