イオンに関する分野の最後の学習内容が「中和と塩」です。酸とアルカリの水溶液を混ぜるとどんな反応が起こるのか見ていきましょう。
中和とは
塩酸のような酸性の水溶液と、水酸化ナトリウムのようなアルカリ性の水溶液を混ぜると、お互いの性質を打ち消し合う反応である中和が起こります。
このとき酸性の水溶液中にある水素イオンH⁺と、アルカリ性の水溶液中にある水酸化物イオンOH⁻が結びつき水H₂Oが生じます。また、それ以外の酸の陰イオンとアルカリの陽イオンが結びつき塩(えん)が同時に生じます。
中和の反応式
- 水素イオン+水酸化物イオン→水
H⁺+OH⁻→H₂O
もっと詳しく見てみると、
- 酸の水溶液+アルカリの水溶液→水+塩
H⁺+A⁻+B⁺+OH⁻→H₂O+BA
できる塩は、混ぜ合わせる酸とアルカリの種類によって変わります。次は代表的な中和の反応を見ていきます。
塩酸と水酸化ナトリウムの中和
酸性の塩酸とアルカリ性の水酸化ナトリウム水溶液を混ぜると次のような反応が起こり、水と塩ができます。
- 塩酸+水酸化ナトリウム水溶液→水+塩化ナトリウム
HCl+NaOH→H₂O+NaCl
この反応をもっと詳しくみてみると、
- 塩酸+水酸化ナトリウム水溶液→水+塩化ナトリウム水溶液
H⁺+Cl⁻+Na⁺+OH⁻→H₂O+Na⁺+Cl⁻
塩酸も水酸化ナトリウム水溶液もどちらも水溶液です。なので電離している状態です。中和反応が起こった後も生じた塩の水溶液になっているので、ナトリウムイオンNa⁺と塩化物イオンCl⁻が水溶液中にあります。
つまり、Na⁺とCl⁻は反応前後で変化していませんので、中和自体の反応は
- 水素イオン+水酸化物イオン→水
H⁺+OH⁻→H₂O
になります。
硫酸と水酸化バリウム水溶液の中和
酸性の硫酸とアルカリ性の水酸化バリウム水溶液を混ぜると次のような反応が起こり、水と塩ができます。
- 硫酸+水酸化バリウム水溶液→水+硫酸バリウム
H₂SO₄+Ba(OH)₂→2H₂O+BaSO₄
このときできる硫酸バリウムという塩は水に溶けにくい塩ですので、白い沈殿になります。
この反応をもう少し詳しくみてみると、
- 硫酸+水酸化バリウム水溶液→水+硫酸バリウム
2H⁺+SO₄²⁻+Ba²⁺+2OH⁻→2H₂O+BaSO₄
硫酸バリウムは水に溶けにくい塩です。中和が起こった後は、電離して水に溶けている状態ではなく、むずびついて白い物質として沈殿します。硫酸と水酸化バリウム水溶液を完全に中和させると、水溶液中にはイオンがまったく存在しない状態になります。つまり、電流が流れなくなることも覚えておきましょう。
中和とイオンの数
酸とアルカリの中和の実験では、イオン数の変化を聞いてくる問題もあります。水素イオンH⁺や水酸化物イオンOH⁻の数がどのように変化するのか見ていきましょう。
塩酸に水酸化ナトリウム水溶液を混ぜる
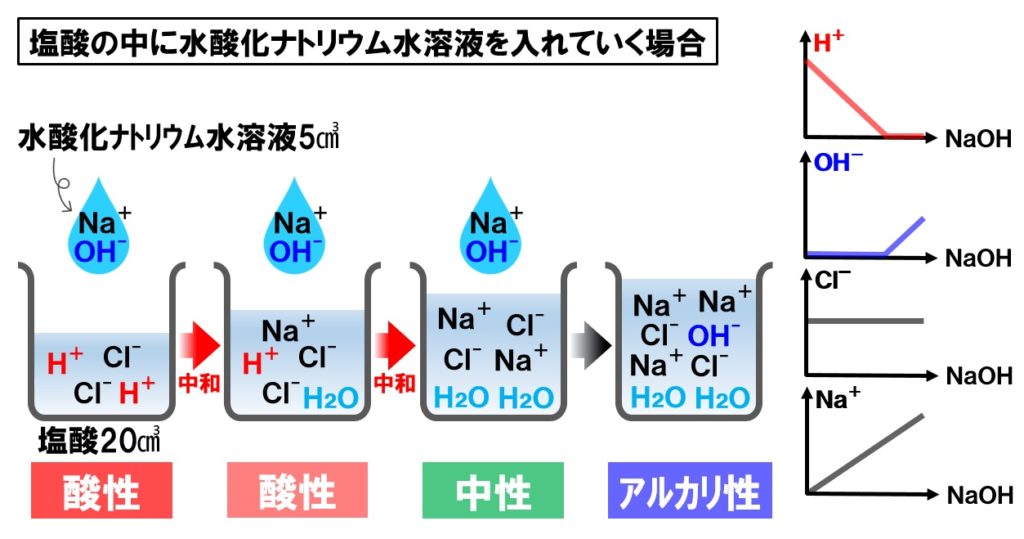
- 水素イオンH⁺…減少し中性になったところで無くなる。
- 水酸化物イオンOH⁻…中性になるまで増えない。中性以降は増加する。
- 塩化物イオンCl⁻…変化しない。
- ナトリウムイオンNa⁺…だんだん増えていく。
水酸化ナトリウム水溶液に塩酸を混ぜる
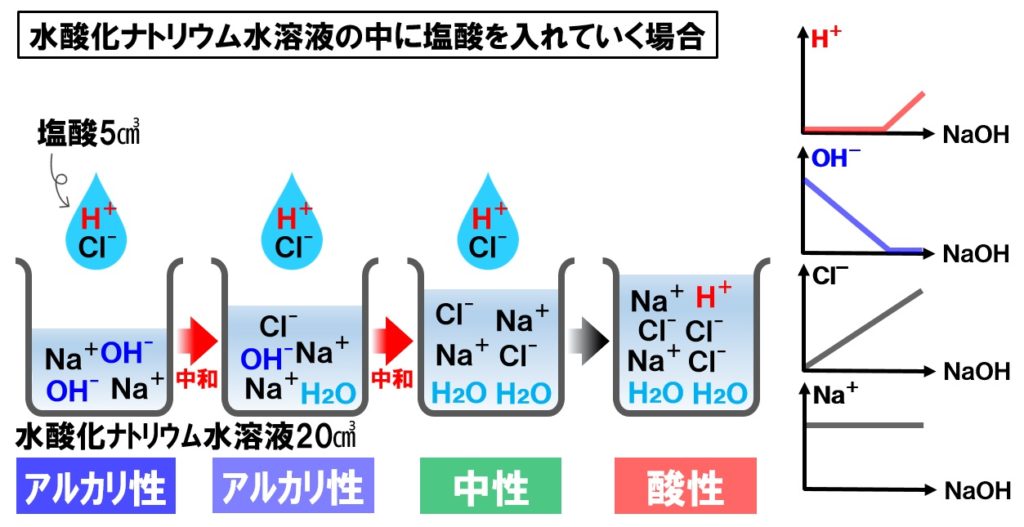
- 水素イオンH⁺…中性になるまで増えない。中性以降は増加する。
- 水酸化物イオンOH⁻…減少し中性になったところで無くなる。
- 塩化物イオンCl⁻…だんだん増えていく。
- ナトリウムイオンNa⁺…変化しない。
対策問題➊ 【定期テスト対策問題】塩酸と水酸化ナトリウム水溶液の中和の問題
対策問題➋ 【定期テスト対策問題】硫酸と水酸化バリウム水溶液の中和の問題・解説
作図問題 【中学理科作図問題】イオン・電離・中和の作図問題



コメント