【中学理科作図問題】化学変化(モデル図・グラフの作図など)の作図問題です。
作図問題「化学変化編」
化学変化の作図では、圧倒的に化学変化のモデル図と、化学変化と質量に関するグラフの作図が出題されています。原子の個数を一致させるようにモデル図を記入したり、グラフの問題ではそれぞれの軸が何を表しているのかをしっかりと考える必要があります。
熱分解での気体の捕集方法
下の図は、酸化銀を加熱しているようすを表している。酸化銀を加熱したときに発生する気体を集める装置として適当な図を、下の図の中に書き入れなさい。ただし、試験管に気体を集めるものとする。
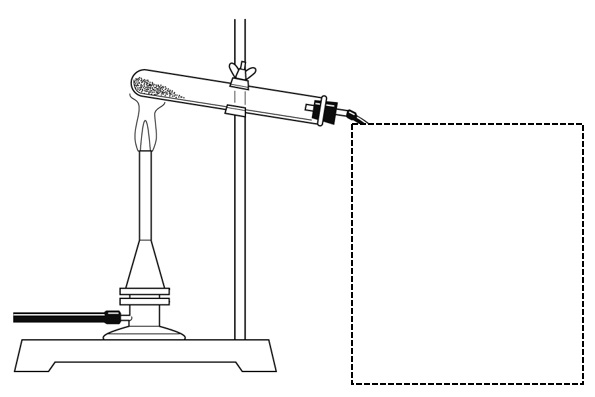
解答
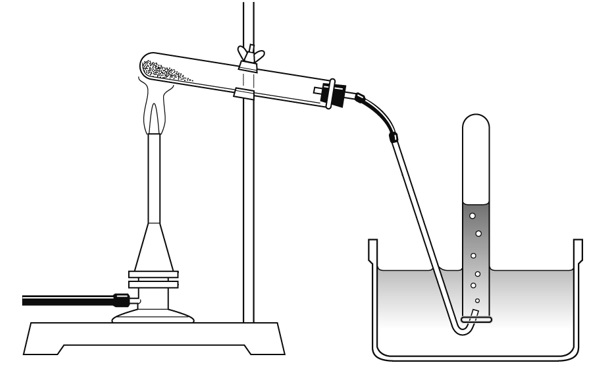
酸化銀を加熱すると、熱分解が起こり、試験管内に白色の銀が残り、酸素が発生する。発生した酸素は水に溶けにくいという性質があるので、水上置換法で集めるとよい。
固体の加熱方法
炭酸水素ナトリウムを加熱する実験を行う際、炭酸水素ナトリウムが入った試験管をどのように加熱するとよいか。下の図の試験管をガスバーナーの炎の上に書き入れ正しい加熱の仕方を示しなさい。
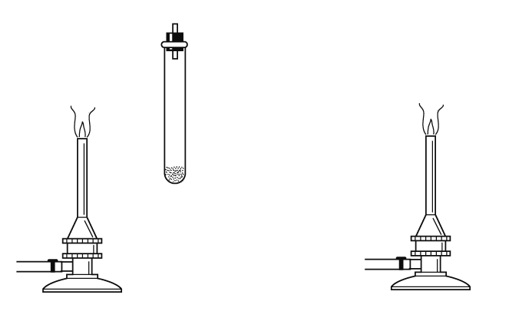
解答
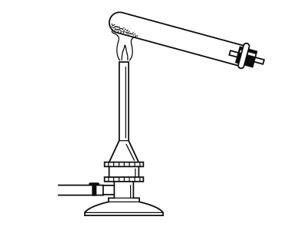
酸化銀や炭酸水素ナトリウムなどの固体を加熱する実験を行い場合、水などの液体が発生する可能性があるので、発生した液体が加熱部に流れ試験管が割れるのを防ぐために、試験管の口のほうを下げて加熱する必要がある。
水の電気分解
水を電気分解すると、水素と酸素が発生する。下の電気分解装置に、発生した気体がたまっているようすを作図しなさい。ただし、発生した気体の体積がわかるように作図すること。
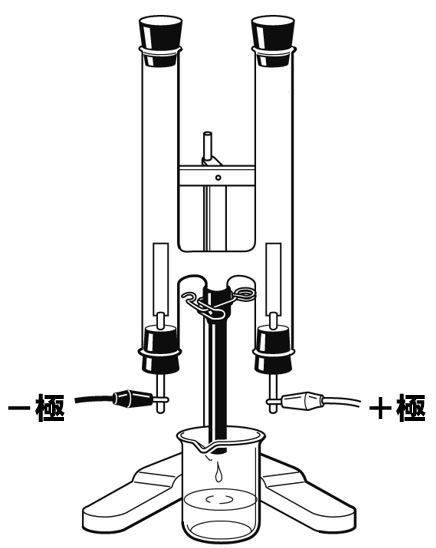
解答
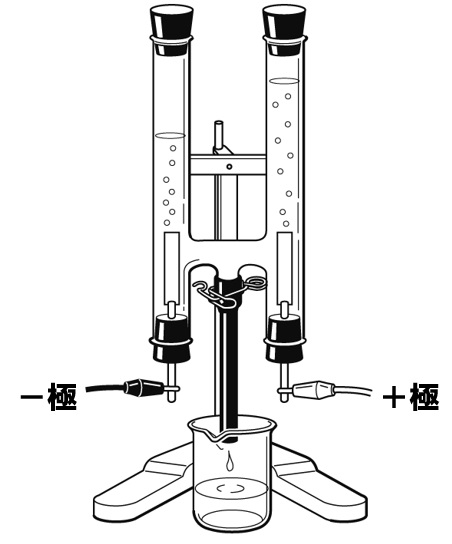
水を電気分解すると、陰極(-極)から水素、陽極(+極)から酸素が発生します。発生する気体の体積比は、水素:酸素=2:1です。
酸化銀の熱分解 モデル図
下のモデル図は、酸化銀を熱分化したようすを表している。酸化銀を加熱すると、銀と酸素に分解されるが、そのようすを下のようにモデルで表しなさい。ただし、銀原子を●、酸素原子を○とする。
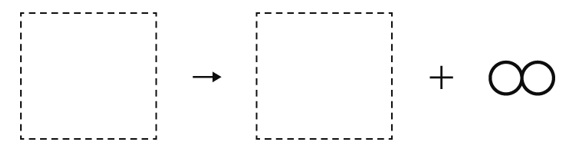
解答
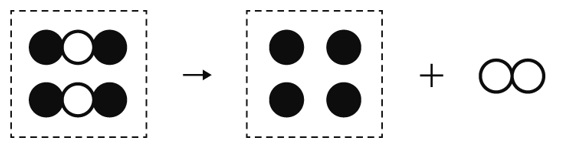
酸化銀を加熱すると、試験管の中に銀が残り、酸素が発生します。化学反応式で、
2Ag2O→4Ag+O2
となります。
酸化銀Ag2Oを2つ、銀Agを4つ、酸素分子O2を2つ書いて、原子の個数を合わせることがポイントです。
水の電気分解 モデル図
下のモデル図は、水の電気分解のようすを表している。化学変化後の粒子のようすを下の図の中に書き入れなさい。ただし、水素原子を○、酸素原子を●とする。

解答
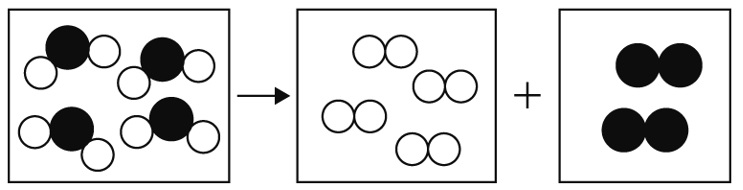
水を電気分解すると、陰極から水素、陽極から酸素が発生します。水分子が4つあるので、生じる水素分子は4つ、酸素分子は2つになります。原子の個数が一致していることをしっかりと確認してください。
酸化銅の還元 モデル図
酸化銅に炭の粉末を混ぜて加熱すると、還元という化学変化が起こる。酸化銅と炭素を混ぜて加熱したときの粒子のようすの変化として正しくなるように、下の図の中に書き入れなさい。ただし、銅原子を●、酸素原子を○、炭素原子を◎とする。
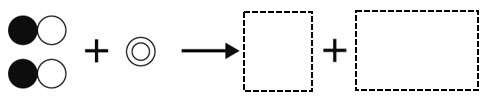
解答
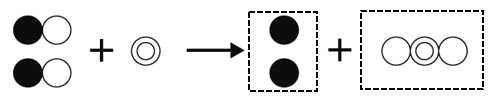
酸化銅CuOに炭素Cを混ぜて加熱すると、酸化銅が還元され銅Cuに、炭素は酸化され二酸化炭素CO2になります。化学反応式は次の通りです。
2CuO+C→2Cu+CO2
原子の個数が両辺で一致するように、CuOを2つ、Cuを2つにします。
鉄と硫黄の硫化
鉄粉と硫黄の粉末を混ぜ、それを加熱する場合、下の図の試験管のどこを加熱すればよいか。加熱する部分に↑(矢印)を書き入れなさい。
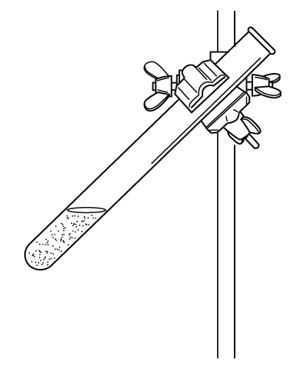
解答
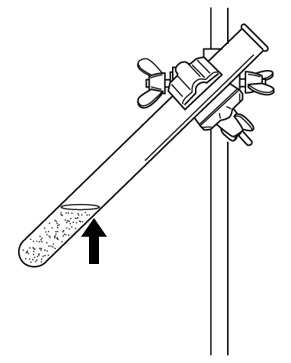
鉄と硫黄が化合するとき、熱が発生します(発熱反応)。試験管の下部を加熱すると、試験管が熱くなりすぎて試験管が割れる恐れがあります。上部を加熱し、一部が赤くなるとガスバーナーの火を止めてください。火を止めた後も、発生した熱で反応が全体に広がります。
マグネシウムの酸化 グラフ
下の表は、マグネシウムを空気中で加熱したときの質量の変化を表している。この表から、マグネシウムの質量と化合した酸素の質量を表すグラフを完成させよ。
| マグネシウム〔g〕 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 | 1.20 |
| 加熱後の質量〔g〕 | 0.33 | 0.67 | 1.0 | 1.33 | 1.67 | 2.00 |
解答
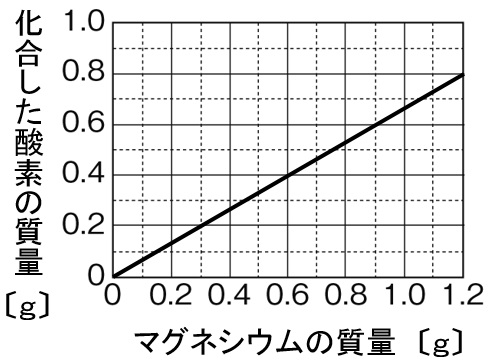
グラフの縦軸を確認すると、化合した酸素の質量をとっているので、表の加熱後の質量から加熱前のマグネシウムの質量を引いて、化合した酸素の質量を求めます。0.60gのMgを加熱すると、加熱後の質量が1.00gになっていることから、化合した酸素は1.00-0.60=0.40gになります。これをグラフに記入すれば完成です。
銅の酸化 グラフ
下の図のように、ステンレス皿の上に銅粉を広げ、空気中で加熱する実験を行った。下のグラフは、そのときの加熱回数と加熱後のステンレス皿の上の物質の質量を表している。このグラフから、銅の質量と酸化銅の質量の関係を表すグラフを完成させよ。
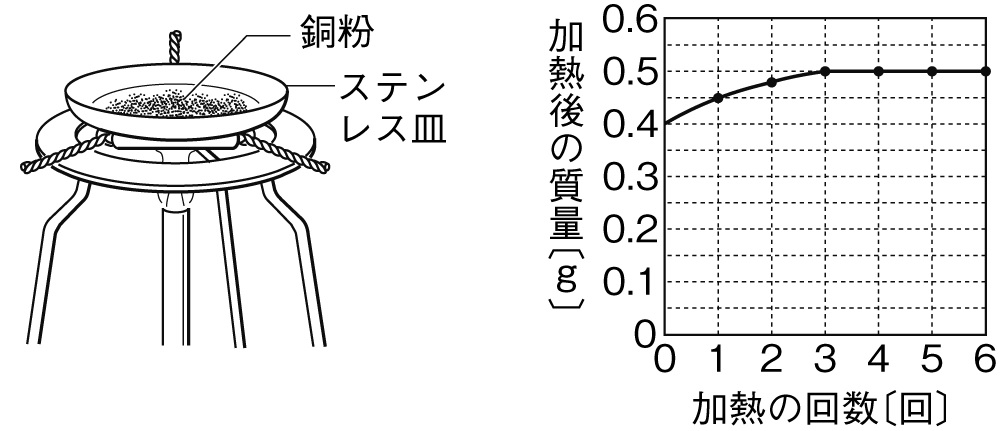
解答
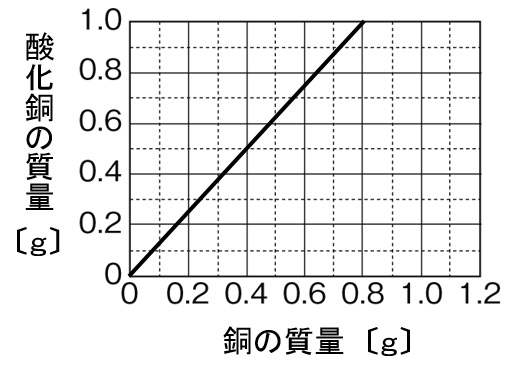
上のグラフの加熱回数が3回目以降は質量が変化していません。これは、0.4gの銅粉が完全に酸素と化合したことを表していて、0.4gの銅に0.1gの酸素が化合して0.5gの酸化銅ができていることがわかります。下のグラフの銅0.4gと酸化銅0.5gの格子点を通るように比例のグラフを書けば完成です。
気体の反応 グラフ
水素と酸素の混合気体を密閉容器に入れ、点火して反応させる実験を行った。水素と酸素の体積を色々変え、混合気体の体積が6.0㎤になるように気体を混ぜ点火させ、密閉容器に残った気体の体積を測定した。そのときのようすを表すグラフを完成させなさい。ただし、水素と酸素は体積比2:1で反応するものとする。
解答
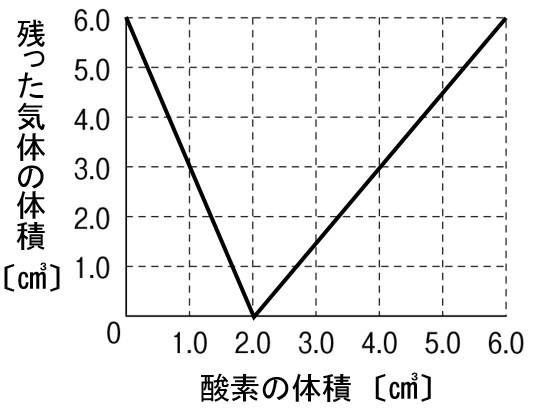
水素と酸素は体積比2:1で反応するので、酸素の体積が1㎤の場合、水素5㎤のうち2㎤のみ反応するので、反応後水素が3㎤残ります。酸素の体積が2㎤の場合、水素4㎤のすべてが反応するので、気体は残りません。酸素の体積が3㎤の場合、水素の3㎤と反応する酸素は1.5㎤になるので、1.5㎤の酸素が残ります。あとはグラフをつなげるだけです。
気体の発生 グラフ
うすい塩酸40gに、石灰石を0.5g加え発生した気体の質量を測定した。その後、石灰石の質量を1.0g、1.5g、2.0g、2.5g、3.0g、3.5gと変え、同じようにうすい塩酸40gに入れ発生する気体の量を測定した。その結果が下の表である。この表から、加えた石灰石と発生した気体の質量を表すグラフを完成させなさい。
| 石灰石の質量〔g〕 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 |
| 気体発生後の全体の質量〔g〕 | 40.3 | 40.6 | 40.9 | 41.2 | 41.7 | 42.2 | 42.7 |
解答
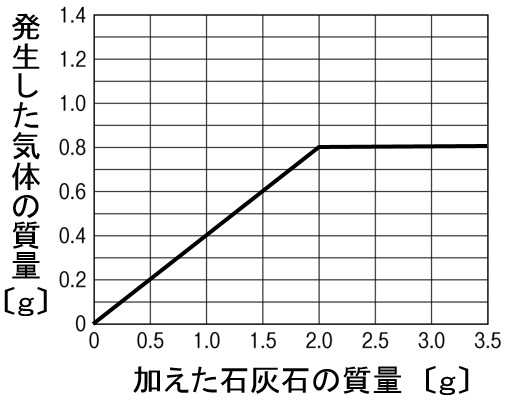
まず、表から発生した二酸化炭素の質量を求めます。うすい塩酸40gに加えた石灰石の質量を足し、そこから気体発生後の全体の質量を引けば空気中に逃げて行った二酸化炭素の質量が求まります。
| 石灰石の質量〔g〕 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 |
| 気体発生後の質量〔g〕 | 40.3 | 40.6 | 40.9 | 41.2 | 41.7 | 42.2 | 42.7 |
| 発生した二酸化炭素の質量〔g〕 | 0.2 | 0.4 | 0.6 | 0.8 | 0.8 | 0.8 | 0.8 |
これをグラフに取ると、上のグラフが完成です。加えた石灰石が2.0g以降、二酸化炭素が0.8gから増えないのは、うすい塩酸40gがすべて反応してしまったからです。
酸化銅の還元 グラフ
酸化銅2.00gに炭素の粉末を混ぜ加熱する実験を行った。加える炭素の質量を変えながら実験を行うと、試験管に残る気体の質量が変化することが分かった。炭素の粉末を0.15g混ぜ加熱したとき、試験管の中には赤褐色の物質だけが残った。このときの加えた炭素と試験管に残った固体の質量を表すグラフを完成させなさい。ただし、銅と酸素は、質量比4:1で反応するものとする。
解答
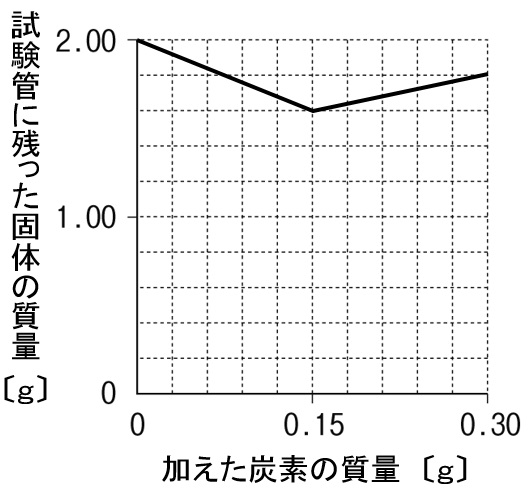
銅と酸素が化合するときの質量比は4:1なので、酸化銅と銅の質量比は5:4になります。したがって、2.00gの酸化銅がすべて還元されると、
5:4=2.00:x これを解くと1.60gの銅ができるとわかります。
加えた炭素が0.15g以降は、還元する酸化銅が無いので、加えた炭素分がそのまま試験管に残ります。
作図問題 【高校入試対策理科】よく出る理科作図問題


コメント